L’ esperienza permette di verificare le previsioni quantitative che riguardano un fenomeno chimico a partire dall’equazione bilanciata che ne descrive formalmente il decorso dallo stato iniziale (reagenti) allo stato finale (prodotti). Nella fattispecie, si determina sperimentalmente la quantità di
Scheda esperimento
| Classi | 2° biennio |
| Tipologia | Strumentazione semplice |
| Durata | 2 h |
 |  |  |  |
Scheda sintetica delle attività
1. PREVISIONE TEORICA Si prende in considerazione l’equazione chimica che descrive la reazione tra bicarbonato di sodio e acido cloridrico e, a partire dai coefficienti stechiometrici, si calcola la quantità teorica di
2. VERIFICA SPERIMENTALE DEI CALCOLI EFFETTUATI Si mette a reagire una mole di bicarbonato di sodio con un eccesso di acido cloridrico in soluzione acquosa. Il sistema è aperto e si lascia disperdere la fase gassosa che si forma nel corso della reazione. La quantità di \(CO_2\) sviluppata si determina, in base alla legge di Lavoisier, per differenza tra la massa totale del sistema nello stato iniziale e la massa totale del sistema nello stato finale. Si confronta il dato sperimentale così ricavato con il dato teorico.
3. PROBLEM – SOLVING L’insegnante propone un quesito-problema per sollecitare gli studenti a definire un protocollo sperimentale risolutivo:
Abbiamo un campione di sale da cucina che si è contaminato con bicarbonato di sodio: come possiamo scoprire la percentuale di bicarbonato presente?
Risorse necessarie
- Bicarbonato di sodio purissimo (va bene anche quello commerciale);
- acido muriatico commerciale;
- acqua distillata;
- due becher o bicchieri di plastica;
- una pipetta o un contagocce qualsiasi;
- una bacchetta per agitare;
- un cucchiaino;
- bilancia tecnica.
Prerequisiti necessari
- Saper bilanciare un’equazione chimica;
- saper calcolare la massa molecolare a partire dalla formula di una sostanza;
- saper fare la conversione da moli a grammi e viceversa;
- conoscere la legge di Lavoisier;
- saper impostare e risolvere proporzioni.
Obiettivi di apprendimento
- Determinare sperimentalmente un rapporto stechiometrico di reazione prodotto/reagente;
- verificare che tale rapporto si mantiene costante se la reazione è quantitativa;
- verificare che la quantità di prodotto che si può ottenere è condizionata dal reagente limitante;
- acquisire la capacità di utilizzare concetti e metodi della Chimica nella risoluzione di problemi pratici.
Dotazioni di sicurezza
E’ necessario adottare misure di sicurezza per l’utilizzo dell’acido muriatico, che è una soluzione diluita di acido cloridrico al 10% circa e può comportare rischi per ingestione, contatto, inalazione. Pertanto si deve operare con:
- guanti di lattice
- camice
- occhiali a mascherina
Svolgimento
1. PREVISIONE TEORICA DELLA QUANTITA’ DI ANIDRIDE CARBONICA CHE SI SVILUPPA DA UNA MOLE DI BICARBONATO DI SODIO
Il bicarbonato di sodio reagisce con l’acido cloridrico secondo la seguente equazione:
\[NaHCO_3 + HCl \longrightarrow NaCl + H_2O + CO_2\ (g)\]
I coefficienti di reazione, tutti unitari, ci dicono che da 1 mole di \(NaHCO_3\) (84 g) si sviluppa 1 mole di \(CO_2\) (44 g)
Questo significa che il rapporto: grammi di \(CO_2\)/grammi di \(NaHCO_3\) è circa 0,524 ovvero per ogni grammo di bicarbonato che reagisce si formano 0,524 g di anidride carbonica.
Questo però è vero solo se la trasformazione del bicarbonato di sodio è quantitativa.
La reazione è in realtà la somma di una serie di fenomeni chimico-fisici che avvengono legando tra loro in una catena di equilibri la fase solida (bicarbonato di sodio), la fase soluzione e la fase gassosa (\(CO_2\) svolta).
1) Il bicarbonato solido si ripartisce anche nella soluzione acquosa (equilibrio di solubilità, eterogeneo);
2) nella soluzione il bicarbonato di sodio si dissocia completamente in ioni (in soluzione);
3) lo ione bicarbonato reagisce con lo ione idronio trasformandosi in acido carbonico (equilibrio acido base in soluzione);
4) l’acido carbonico si decompone in \(H_2O\) e \(CO_2\) disciolta (equilibrio omogeneo in soluzione);
5) la \(CO_2\) disciolta si ripartisce anche nella fase gassosa (bollicine) (equilibrio eterogeneo di ripartizione tra fasi).
In questa catena di equilibri la driving force che può spingere alla decomposizione quantitativa il bicarbonato di sodio è certamente l’allontanamento continuo della \(CO_2\) gassosa dall’ambiente di reazione.
Operando quindi in un sistema aperto, agitando energicamente la soluzione ed assicurando un ambiente acido (per eccesso di \(HCl\) aggiunto), eventualmente anche con un moderato riscaldamento, si realizzano le condizioni necessarie a rendere praticamente irreversibile l’ultima tappa della catena di reazioni sopra descritte e, dunque, a rendere praticamente quantitativa la reazione globale
\[NaHCO_3 + HCl \longrightarrow NaCl + H_2O + CO_2\ (g)\]
2. VERIFICA SPERIMENTALE: DETERMINAZIONE DEL RAPPORTO IN GRAMMI DI CO2/GRAMMI DI NaHCO3
- Pesare 1,0 g di bicarbonato di sodio e introdurlo in un becher aggiungere un po’ di acqua demineralizzata (non importa quanta, deve solo coprire il bicarbonato). Agitare con una bacchetta che non deve essere più tolta dal becher.
- Annotare la massa complessiva iniziale \(MB_0\) di questo sistema (becher + acqua + 1g di bicarbonato+ bacchetta).
- In un altro becher versare circa 50 ml di acido muriatico, introdurre la pipetta che servirà a trasferirlo successivamente nel becher del bicarbonato. Annotare la massa complessiva iniziale \(MA_0\) del sistema (becher + acido + pipetta).
- Ricavare la massa totale del sistema nello stato iniziale uguale a (\(MA_0+MB_0\)).
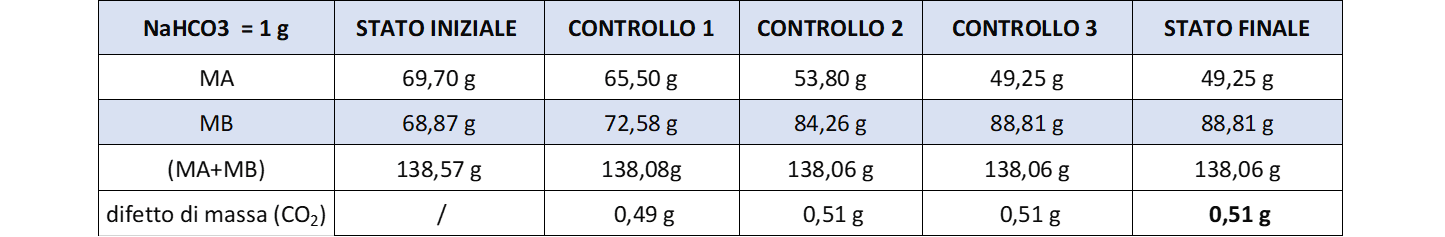
- Trasferire goccia a goccia con la pipetta l’acido nella soluzione di bicarbonato. Si sviluppa una vivace effervescenza che scompare velocemente per agitazione con la bacchetta (che non deve mai essere tolta dal becher). Occorre aggiungere acido in eccesso fino a che, per ulteriore aggiunta, non compare più alcuna effervescenza.A questo punto si può sospendere l’aggiunta di acido. Attendere qualche minuto e riportare alla bilancia i due becher, avendo cura di ripesarli nelle stesse condizioni iniziali (pipetta nel becher dell’acido e bacchetta nel becher dove è avvenuta la reazione). Annotare le rispettive masse (CONTROLLO 1).
- Ricavare la massa totale del sistema nello stato intermedio di CONTROLLO 1 = (\(MA_1+MB_1\)).
- Riprendere l’aggiunta di un’ulteriore eccesso di acido per poter effettuare un secondo controllo. Annotare di nuovo i valori di MA e MB (CONTROLLO 2).
- Se al controllo 2 si registra un valore complessivo (\(MA_2+MB_2\)) più basso rispetto al controllo 1 vuol dire che la reazione non era arrivata a completezza ed è quindi necessario continuare ad aggiungere altro acido. Ripesare ed annotare MA e MB (CONTROLLO 3)L’aggiunta di acido si può interrompere quando, ad un successivo controllo, non si registra più variazione del valore \((MA_F+MB_F)\) (STATO FINALE).

La massa di \(CO_2\) prodotta si calcola in base alla legge di Lavoisier come difetto di massa tra lo stato iniziale e lo stato finale e risulta:
\(M_{CO_2} = (MA_0 + MB_0) – (MA_F + MB_F)\)
Tabella 1 riporta i dati dell’esperimento:
3. PROBLEM – SOLVING: ANALISI DI UN CAMPIONE COSTITUITO DA SALE DA CUCINA E BICARBONATO DI SODIO
L’insegnante solleva un quesito-problema: Abbiamo un campione costituito solamente da bicarbonato e sale da cucina.
Come possiamo determinare la composizione percentuale dei due componenti?
Il lavoro e le osservazioni condotte nelle prime due fasi dovrebbero costituire la base di partenza per progettare un protocollo sperimentale che possa permettere di risolvere il problema e dare una risposta al quesito.
Attraverso una discussione guidata, si raccolgono i dati e le informazioni utili per la risoluzione del problema:
- Il comune sale da cucina è cloruro di sodio;
- il bicarbonato reagisce con l’acido cloridrico, il cloruro di sodio no;
- entrambi sono solubili in acqua;
- la \(CO_2\) che si sviluppa è proporzionale alla quantità di bicarbonato che reagisce;
- il rapporto: grammi di \(CO_2\) /grammi di \(NaHCO_3\) è pari a circa 0,52.
Si definisce una strategia di risoluzione del problema:
- si pesa il campione;
- si aggiunge un eccesso di acido cloridrico: soltanto il bicarbonato reagirà, sviluppando \(CO_2\);
- si determina la massa di gas prodotto (come nella metodica precedente);
- si risale alla massa di bicarbonato presente nel campione (grammi di \(NaHCO_3\) = grammi \(CO_2\) / 0,52);si calcola il rapporto: grammi di \(NaHCO_3\) / grammi di CAMPIONE e lo si moltiplica per 100 (% di \(NaHCO_3\));
- si determina quindi la % di NaCl.
Si passa alla realizzazione della sequenza operativa (a gruppi) e si confrontano i dati.
L’insegnante può decidere di assegnare a ciascun gruppo campioni di composizione diversa oppure identica. In ogni caso si porrà il problema di come arrivare al risultato più attendibile:
analizzare tutto il campione in un’unica volta o frazionarlo per effettuare più prove?
E come procedere al frazionamento? Direttamente sulla fase solida o preparando una soluzione da cui prelevare una porzione?
Si può suggerire di percorrere entrambe le vie (alcuni gruppi lavorano sul campione intero, altri su piccole porzioni) per poi discutere sui risultati ottenuti.
Note e storia
La metodica permette di ottenere un ottimo accordo tra previsione teorica e dato sperimentale per quanto riguarda la massa di \(CO_2\) ottenuta.
Inoltre, permette di verificare che ad un certo punto il difetto di massa resta costante anche se si continua ad aggiungere altro acido: è il principio del reagente limitante. L’aggiunta di un reagente in eccesso (in questo caso l’acido) non determina una maggiore quantità di prodotto.
Variando la quantità di bicarbonato di partenza si ottiene una buona costanza dei risultati dalla quale è possibile compiere una significativa generalizzazione: le proporzioni tra reagenti e prodotti sono definite (dai coefficienti di reazione) e costanti (se il processo è quantitativo).
Per quanto riguarda l’analisi del campione incognito, che è una miscela solida, sarà importante far osservare che un frazionamento del campione direttamente dalla fase solida porterebbe ad analizzare porzioni eterogenee nella composizione mentre portando in soluzione l’intera massa si possono poi prelevare volumi a piacere di composizione omogenea.
Autori
Storti Roberta