Riassunto / Abstract
Nell’ambito di un percorso puramente logico-deduttivo si può giungere al concetto di mole anche senza entrare all’interno di un laboratorio. Si parte dal principio di Avogadro: si fanno immaginare agli studenti due cubi di vetro identici che, contenendo due gas diversi alla stessa temperatura e pressione, devono logicamente contenere lo stesso numero di particelle. Quindi si procede in modo simile a come fece Cannizzaro: se si immagina di pesare i due gas le loro masse stanno nello stesso rapporto in cui stanno le masse delle singole particelle. Quindi si considera la più leggera, l’idrogeno, e si costruisce una scala arbitraria e relativa in cui la massa dell’idrogeno è pari ad uno. Considerando quantità in grammi pari a tali valori si giunge al concetto di mole. A questo punto l’unico concetto che sono costretto ad introdurre in modo non logico-deduttivo è il numero di Avogadro. Si può dare una stima di tale valore riempiendo una bacinella con dell’acqua, disperdendovi sulla superficie mediante un setaccio un sottile strato di polvere di licopodio (o di borotalco), e deponendovi al centro 0,1mL di una soluzione diluita di acido oleico precedentemente preparata. Dalla misura del diametro della macchia che si viene a formare, si giunge, con semplici calcoli, ad una stima del valore del numero di Avogadro.
Scheda sintetica delle attività
Prima parte teorica (in classe)
Introduco il concetto di mole seguendo un percorso puramente logico- deduttivo al termine del quale definisco la mole come quella quantità in grammi pari alla massa atomica (o molecolare) che contiene un numero determinato di atomi (o di molecole).
Seconda parte sperimentale (in laboratorio)
Determino tale numero misurando il diametro di una macchia di acido oleico diluito in etere etilico depositata sulla superficie di un contenitore pieno d’acqua sulla quale ho precedentemente disperso una sottile polvere di licopodio (o più semplicemente di borotalco).
Risorse necessarie
- 1 vaschetta di plastica di forma circolare (circa 50 cm di diametro);
- 1 microsiringa da 1 mL (sensibilità pari a 0,1 mL);
- 4 pipette graduate da 10 mL (sensibilità pari a 1 mL);
- 4 provette;
- 1 setaccio;
- 1 righello da 20 cm;
- acido oleico (oppure olio di oliva);
- etere di petrolio;
- polvere di licopodio (oppure borotalco).
Prerequisiti necessari
- Conoscenza di grandezze e loro unità di misura (massa, volume, densità);
- conoscenza della classificazione dei principali sistemi chimici (concetto di soluzione);
- conoscenza dell’ipotesi atomica (Dalton);
- conoscenza delle condizioni di miscibilità di sostanze apolari.
Obiettivi di apprendimento
Competenze operative:
- utilizzo di una microsiringa;
Competenze metodologiche:
- capacità di costruzione di un modello a partire da una situazione reale;
- capacità di costruzione di una percorso logico;
- capacità di interpretazione di dati sperimentali.
Competenze conoscitive:
- conoscenza del concetto di scala arbitraria e relativa;
- conoscenza del concetto di massa atomica;
- conscenza del concetto di mole;
- conoscenza del significato del numero di Avogadro.
Competenze interpretative:
- capacità di utilizzare un modello per spiegare il concetto di mole;
- capacità di dare una stima del numero di Avogadro a partire dall’ipotesi del monostrato molecolare.
Dotazioni di sicurezza
Nessuna
Svolgimento
Prima parte teorica (in classe): introduzione del concetto di mole
Si disegnano sulla lavagna due cubi identici. Si invitano gli studenti ad immaginare di introdurre all’interno di ogni cubo piccole quantità di due gas diversi (ad esempio idrogeno ed ossigeno). Si stimolano i ragazzi a produrre un modello microscopico dei gas all’interno di ogni singolo cubo. L’immagine più intuitiva è quella particellare: piccole sfere di tipologia diversa (ad esempio di due colori diversi: blu e rosse). La temperatura è per ipotesi di partenza uguale nei due cubi. La temperatura deve essere in qualche modo legata alla velocità (media) con cui queste particelle si muovono. Anche la pressione è per assunto iniziale uguale. Gli urti delle particelle sulle superfici interne, identiche, dei due contenitori sono (trascurando per semplicità gli urti tra le particelle stesse) la causa microscopica della pressione. In questo nostro modello temperatura e pressione, essendo uguali i volumi, possono essere uguali solo se le particelle sono uguali fra loro in numero. Su questa catena di deduzioni si può approfondire in un secondo momento facendo ragionare gli studenti su quali siano le condizioni affinché il nostro modello si avvicini il più possibile ad una situazione reale (abbiamo introdotto piccole quantità di gas…).
Nota: il principio di Avogadro è una legge limite; ossia rigorosamente vera solo al limite di
Se particelle dei due gas sono uguali in numero il rapporto fra le masse dei due gas deve essere uguale al rapporto fra le masse delle singole particelle. Poniamo la più leggera, la particella di idrogeno, uguale ad uno (1 unità di massa atomica) e costruiamo (Cannizzaro) una scala arbitraria e relativa di masse atomiche.
Sino a questo punto abbiamo utilizzato di proposito il termine “particelle” riservandoci di rendere più complesso il discorso in un secondo momento differenziando fra elementi monoatomici (insiemi di atomi), elementi biatomici (insiemi di molecole) e composti (insiemi di molecole) ed introducendo la differenza fra massa atomica e massa molecolare come semplice somma di masse atomiche.
Quando si affrontano i modelli atomici e si giunge al concetto di isotopo, si può perfezionare il concetto di unità di massa atomica passando dal singolo atomo di idrogeno alla dodicesima parte del carbonio 12.
A questo punto riprendendo la scala delle masse atomiche con l’atomo di idrogeno come riferimento possiamo far ragionare gli studenti invitandoli a considerare quantità in grammi pari alla massa atomica, se ci stiamo riferendo ad elementi monoatomici (ad esempio i gas nobili), o pari alla massa molecolare se ci stiamo riferendo ad elementi biatomici o a composti. Tali quantità conterranno logicamente anch’esse uno stesso numero di particelle (atomi o molecole). Chiamiamo tale quantità mole. Il numero di particelle uguale in queste quantità è il numero di Avogadro e se può dare una stima sperimentale nella parte successiva.
La mole quindi risulta essere definita come:” una quantità in grammi pari alla massa atomica se ci stiamo riferendo ad elementi monoatomici o pari alla massa molecolare se ci stiamo riferendo ad elementi biatomici o a composti; tale quantità contiene un ugual numero di particelle (atomi o molecole)“.
Seconda parte sperimentale (in laboratorio): determinazione del numero di Avogadro
Operazioni preliminari
Si prepari una soluzione diluita 1:10000 di acido oleico in etere di petrolio (tale operazione può essere effettuata separatamente dall’insegnante o può essere già parte integrante dell’esperienza di laboratorio) procedendo come segue: con la pipetta si preleva 1 mL di acido oleico e si diluisce in una provetta con 9 mL di etere di petrolio. Dalla soluzione ottenuta si preleva con una seconda pipetta 1 mL e si diluisce in una seconda provette con altri 9 mL di etere di petrolio. Si ripete la stessa operazione per altre due volte ottenendo così la soluzione desiderata.

Esecuzione dell’esperimento (in piccoli gruppi)
Si versi dell’acqua, non necessariamente distillata, nelle vaschetta fino a metà del suo volume e la lasci riposare fino a quando la sua superficie non appaia perfettamente immobile. Si sparga su di essa aiutandosi con un setaccio uno stato molto sottile di polvere di licopodio, reperibile in erboristeria. In mancanza di tale sostanza si può utilizzare più semplicemente del borotalco ma avendo dei granuli di dimensioni maggiori è più difficile in un secondo momento ottenere una macchia circolare. Si prelevi con la microsiringa 0,1 mL della soluzione diluita di acido oleico (che corrisponde a \(10^{-5}\ mL\) di acido oleico puro) e lo si depositi al centro della vaschetta tutto insieme, rapidamente, avvicinandosi il più possibile alla superficie dell’acqua. Si formerà una macchia circolare il cui perimetro è individuato dalla polvere di licopodio. Attendendo alcuni minuti l’etere di petrolio evapora. Si forma un sottilissimo strato oleoso che può essere considerato, in buona approssimazione, monomolecolare. Si misuri il diametro della macchia con il righello e lo si riporti sul quaderno di laboratorio.

La logica dell’esperimento
Immaginiamo la macchia di acido oleico come una moneta di spessore sottilissimo che galleggia sulla superficie dell’acqua. Tale spessore ovviamente non può essere misurato direttamente ma conoscendo noi il volume della macchia (\(10^{-5}\ mL\ =\ 10^{-5}\ cm^3\)) e la sua superficie (ricavabile dal diametro misurato in precedenza) lo possiamo facilmente ottenere dividendo il primo per la seconda.
Pensiamo ora alla sezione della macchia. È un rettangolo. All’interno di questo rettangolo immaginiamo le singole molecole di acido oleico come delle circonferenze disposte le una adiacenti alle altre vista la nostra ipotesi di monostrato molecolare. È chiaro che la metà dello spessore è pari al raggio di queste circonferenze, rappresentanti la sezione della singola molecola pensata a sua volta come una sfera.
Dal raggio molecolare possiamo, utilizzando la formula del volume di una sfera, ottenere il volume molecolare. Poiché l’acido oleico ha formula molecolare pari a \(C_{18}H_{34}O_2\) la massa di una sua mole sarà pari a 282 grammi. Nota la densità dell’acido oleico (\(0,873\ g/mL\ =\ 0,873\ g/cm^3\) ) dividendo la massa molare per la densità si ottiene il volume molare. Dividendo il volume molare per il volume molecolare si ottiene il numero di Avogadro.
Ricapitolando, abbiamo dunque rappresentato la singola molecola come una sfera e indicato con:
- D il diametro della macchia;
- A l’area macchia: \(A = \pi \frac{D}{2}^2\) ;
- V il volume della macchia: V=\(10^{-5}\ mL\ =\ 10^{-5}\ cm^3\);
- h lo spessore della macchia: \(h = \frac{V}{A}\);
- r il raggio molecolare: \(r = \frac{h}{2}\);
- \(V_{molecolare} = \frac{4}{3} \pi r^3\)
- d la densità dell’ acido oleico: 0,873 g/mL=0,873 g/cm;
- MM la massa molare acido oleico: 282 g/mol;
- \(V_{molare}\) il volume molare: \(V_{molare} = \frac{MM}{d}\);
- \(N_0 il numero di Avogadro calcolato: \(N_0 = \frac{V{molare}}{V_{molecolare}}\).
Si può ripetere la procedura immaginando la singola molecola di acido oleico come un cubo o come un cilindro avente diametro pari alla sua altezza e confrontare i risultati con quelli precedentemente ottenuti.
Se ipotizziamo che la singola molecola abbia la forma di un cubo di lato h le formule precedenti sono ovviamente identiche, basta modificare il volume molecolare: \(V_{molecolare} = h^3\).
Come ultima ipotesi pensiamo invece alla singola molecola come ad un cilindro equilatero (ossia di altezza h e sezione di base avente un diametro pari ad h): le formule precedenti sono ovviamente identiche, basta sostituire: \(V_{molecolare} = h\ \pi (\frac{h}{2})^2\).
Vediamo il tutto in un caso reale di un’esperienza svolta in laboratorio.
Il diametro della macchia che i ragazzi hanno trovato e’ risultato essere pari a: \(D\ =\ 12.2\ cm\).
Per questa misura, si può seguire la via più semplice, ossia effettuare un’esperienza singola (ovviamente con la guida del docente e la partecipazione di alcuni ragazzi).
Se si preferisce suddividere la classe in piccoli gruppi ed effettuare più misure, fare la media dei risultati ottenuti con la formula:
\(D_{medio} = \frac{1}{n} \sum_i D_i\)
dove n è numero dei gruppi e \(D_i\) il diametro misurato da ogni singolo gruppo.
E’ bene prendere tre cifre significative (anche la densità e la massa molare dell’acido oleico sono state espresse con tre cifre significative) e mantenerle anche nei calcoli successivi, evitando così il calcolo degli errori attraverso la teoria della propagazione che, utilizzando le derivate, a mio avviso, risulterebbe di non facile comprensione per ragazzi delle prime classi delle superiori.
Tabella 1 riassume i risultati ottenuti:
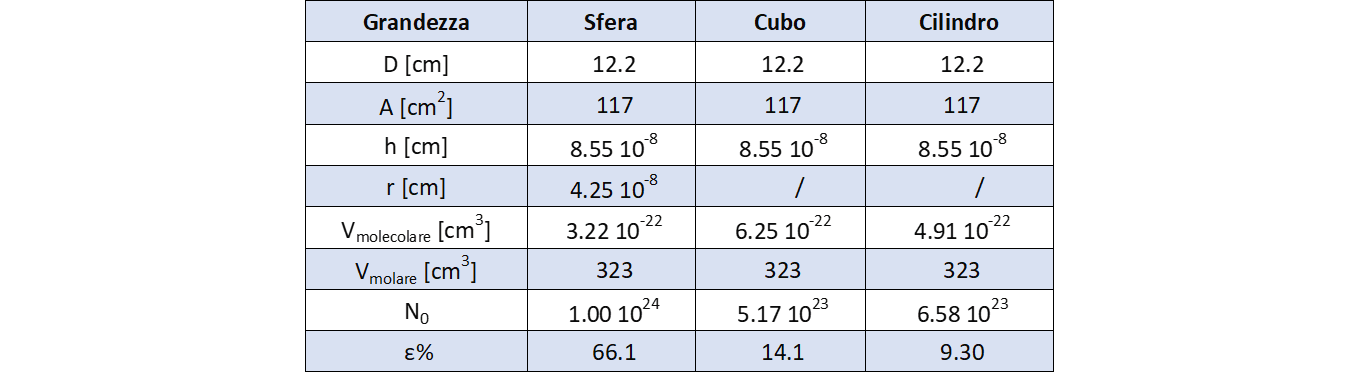
Confrontiamo ora i valori ottenuti con un valore per così dire “attendibile” del numero di Avogadro, chiamiamolo \(N_A\), preso ad esempio dal P.W. Atkins (vd. Bibliografia); infatti il cosiddetto “valore vero” di \(N_A\) non è accessibile dato che il numero di Avogadro è sempre il risultato di un qualche tipo di misura. Assumiamo come valore: \(N_A = 6,02 \cdot 10^{23}\).
Possiamo dunque, semplicemente, limitarci al calcolo dell’errore relativo percentuale per avere un’idea di quale sia la forma della molecola che meglio la rappresenta, applicando la semplice formula:
\[\epsilon \% = \frac{|N_0 – N_A|}{N_A}\]
Dati i valori ottenuti (tabella 1, ultima riga) si può giungere alla conclusione che la forma che meglio rappresenta la molecola di acido oleico sia il cilindro equilatero, questo lascerebbe immaginare che la molecola di acido oleico tenda ad arrotolare la sua lunga coda descrivendo come migliore approssimazione proprio il volume di un piccolo cilindro.
Note e storia
Nota 1: l’unica difficoltà di questa esperienza risiede nel fatto di ottenere una macchia il più possibile circolare. Per ottenere questo risultato gli accorgimenti sono in primo luogo l’utilizzo della polvere di licopodio che risulta avere granuli molto sottili. In secondo luogo la formazione di uno strato il più possibile sottile ed omogeneo di tale polvere (aiutandosi con il setaccio). In terzo luogo la punta della siringa va avvicinata il più possibile alla superficie dell’acqua e l’acido oleico va depositato velocemente in un’unica soluzione senza farlo gocciolare.
Nota 2: l’utilizzo di olio di oliva al posto dell’acido oleico ha come limite l’ottenimento di risultati molto meno riproducibili.
Nota 3: La recente ridefinizione delle unità di misura del Sistema Internazionale del 2019 ha assegnato al numero di Avogadro un valore esatto pari a:
\[N_A = 6,02214076 \cdot 10^{23}\ mol^{-1}\]
Bibliografia
- P.W.Atkins, Chimica fisica, Zanichelli.
Autori
Cantarella Gaetano
Specifiche esperimentoMateria Chimica Classi a cui è rivolto 2° biennio Tipologia di laboratorio Povero Reperibilità del materiale Uso quotidiano Materiale specifico Vetreria da laboratorio, micropipette, acido oleico oppure olio d’oliva, etere di petrolio, polvere di licopodio o borotalco Durata esperimento in classe 2 h Capacità di bricolage/assemblaggio No Necessità lavorazioni meccaniche/elettroniche No Necessità PC per acqusizione/analisi dati No Necessità di uno smartphone No Parole chiave Chimica Stechiometria Mole Numero di Avogadro |