Riassunto / Abstract
Si analizza il comportamento acido-base di varie sostanze di uso comune dividendole operativamente in sostanze acide, neutre o basiche in base alla loro interazione con due diversi indicatori di pH, il blu di bromotimolo e l’estratto di cavolo rosso preparato a casa dagli studenti (vedi scheda 9-Scienze)
Questa scheda fa parte di un percorso di didattica laboratoriale diviso in 2 parti (10-Scienze, 25-Scienze) che possono essere adottate singolarmente o come percorso completo al fine di definire il concetto di acido e base attraverso l’analisi delle loro proprietà e reattività.
La scheda 25-Scienze cercherà di definire qualitativamente e quantitativamente il rapporto di reattività acido-base attraverso delle titolazioni.
Il percorso di questa unità potrà essere continuato anche con l’analisi dei pH dei suoli.
Scheda sintetica delle attività
In questa scheda si analizzerà il comportamento acido-base di varie sostanze di uso comune dividendole operativamente in sostanze acide, neutre o basiche in base alla loro interazione con due diversi indicatori di pH, il blu di bromotimolo, la fenoftaleina, l’estratto di cavolo rosso preparato a casa dagli studenti (vedi esperimento 9-Scienze) e la cartina universale.
La definizione operativa di acido o base attraverso la risposta di un indicatore serve a far comprendere che molecole diverse devono avere una parte simile perché producono lo stesso risultato tangibile ossia la variazione di colore di una sostanza chimica complessa.
Risorse necessarie
- Vetreria da laboratorio: provette, porta provette, bacchette di vetro (sostituibile con bicchieri, piatti e cannucce di plastica);
- reagenti chimici: HCl (acido muriatico), NaOH (pastiglie di soda per sgorgare i lavandini), e tutti quelli presenti in casa;
- soluzione di metil arancio;
- soluzione di fenolftaleina;
- soluzione di rosso fenolo;
- soluzione di estratto di cavolo rosso (vedi esperienza 9-Scienze);
- cartina universale.
Prerequisiti necessari
- Sapere cosa è una soluzione e come si prepara;
- sapere esprimere la concentrazione di una soluzione sia in rapporti massa/volume che in moli;
- conoscere i logaritmi e le operazioni su di essi.
Obiettivi di apprendimento
Capacità di lavorare in gruppo attraverso la cooperazione e la collaborazione;
utilizzare il metodo scientifico nell’osservazione delle cose che ci circondano;
capacità di applicare le conoscenze chimiche alle esperienze di vita pratica;
saper spiegare e argomentare alcuni temi scientifici ad altri;
saper definire gli acidi e le basi secondo una prima base di reattività;
capacità di utilizzare un indicatore di acidità/basicità.
Dotazioni di sicurezza
Acidi e basi forti sono corrosivi e devono essere usati con gli opportuni sistemi di protezione individuale (guanti, camice e occhiali). La preparazione di soluzioni diluite da acidi forti volatili (HCl, acido acetico, ecc.) deve essere effettuata sotto cappa aspirante. Si raccomanda di leggere le schede di sicurezza dei reattivi utilizzati, delle quali è obbligatoria la presenza in laboratorio come da norma di legge. Sarà buona norma preparare una soluzione satura di bicarbonato da usare per neutralizzare prontamente eventuali perdite di prodotti acidi e una di acido acetico 0,1 M per neutralizzare i prodotto basici. In caso di contatto accidentale con acidi o basi la prima cosa da fare è togliere gli indumenti eventualmente contaminati e lavare copiosamente con acqua corrente la parte colpita fino a scomparsa del brucione. Le soluzioni di
Svolgimento
L’esperienza è pensata per una classe (2° anno) in cui non siano già stati introdotti i concetti di acido e base e di pH ma può anche essere vista come un approccio sperimentale di conferma delle teorie già presentate agli studenti (3° anno).
Prerequisiti e Discussione iniziale.
L’esperienza può essere intesa come un primo approccio al concetto di acido e base anche senza introdurre la teoria di Arhrenius in modo che gli studenti “costruiscano operativamente” il concetto attraverso le prove sperimentali.
A tal fine nella discussione iniziale sarà importante controllare quanto i ragazzi sanno sull’argomento attraverso le conoscenze pregresse sia scolastiche che della vita di tutti i giorni. Si potrà così notare che l’idea di acido è molto comune e viene correlata a sostanze aspre (limone), che possono bruciare (acido gastrico) mentre l’idea di base è molto meno utilizzata nel parlare comune anche se molte basi forti vengono accomunate agli acidi nella categoria di sostanze pericolose e “caustiche”.
Per partire sarà quindi opportuno contrapporre le “basi” come sostanze che reagiscono con gli acidi. Inoltre si dovrà fare una introduzione semplice al concetto di indicatore come sostanza che può presentare differenti colorazioni se messa in presenza di composti differenti.
La lezione di rinforzo delle preconoscenze potrà essere usata anche per discutere l’esperienza di laboratorio, organizzando la ricerca, da parte degli studenti, delle sostanze da portare in laboratorio per l’esperienza.
L’insegnante dovrà evidenziare che si lavorerà con sostanze corrosive e caustiche e le possibili implicazioni di uno scorretto uso delle medesime (leggi NOTE DI SICUREZZA per importanti informazioni sull’argomento!!)
In particolare, sarà opportuno dare disposizioni sui quantitativi da portare (basta 1 bottiglia di sostanza di ogni tipo per tutta la classe!). L’insegnante dovrà dare informazioni agli studenti su come eventualmente travasare una sostanze dal recipiente originale e come etichettare opportunamente il contenitore in modo da avere tutte le informazioni utili per l’esperienza.
Evitare che gli studenti travasino o diluiscano a casa l’acido muriatico (HCl concentrato). In questo caso sarà meglio che la diluizione del composto sia fatta dall’insegnante in laboratorio possibilmente sotto cappa aspirante.
Ricordate che gli acidi forti vanno diluiti aggiungendoli all’acqua e non viceversa per diminuire gli schizzi dovuti alla forte esotermicità del processo.
Ricordate ai ragazzi che le sostanze fortemente basiche rovinano il vetro e che quindi conviene trasportarle con recipienti di plastica, possibilmente resistenti e ben chiudibili.
Normali sostanze di uso domestico che possono essere prese in considerazione
In tabella 1 sono elencate una serie di sostanze facilmente reperibili sul mercato che possono essere usate per analizzare i comportamenti dal punto di vista acido-base. Si dovrebbe cercare di avere concentrazioni opportune dei vari reattivi.
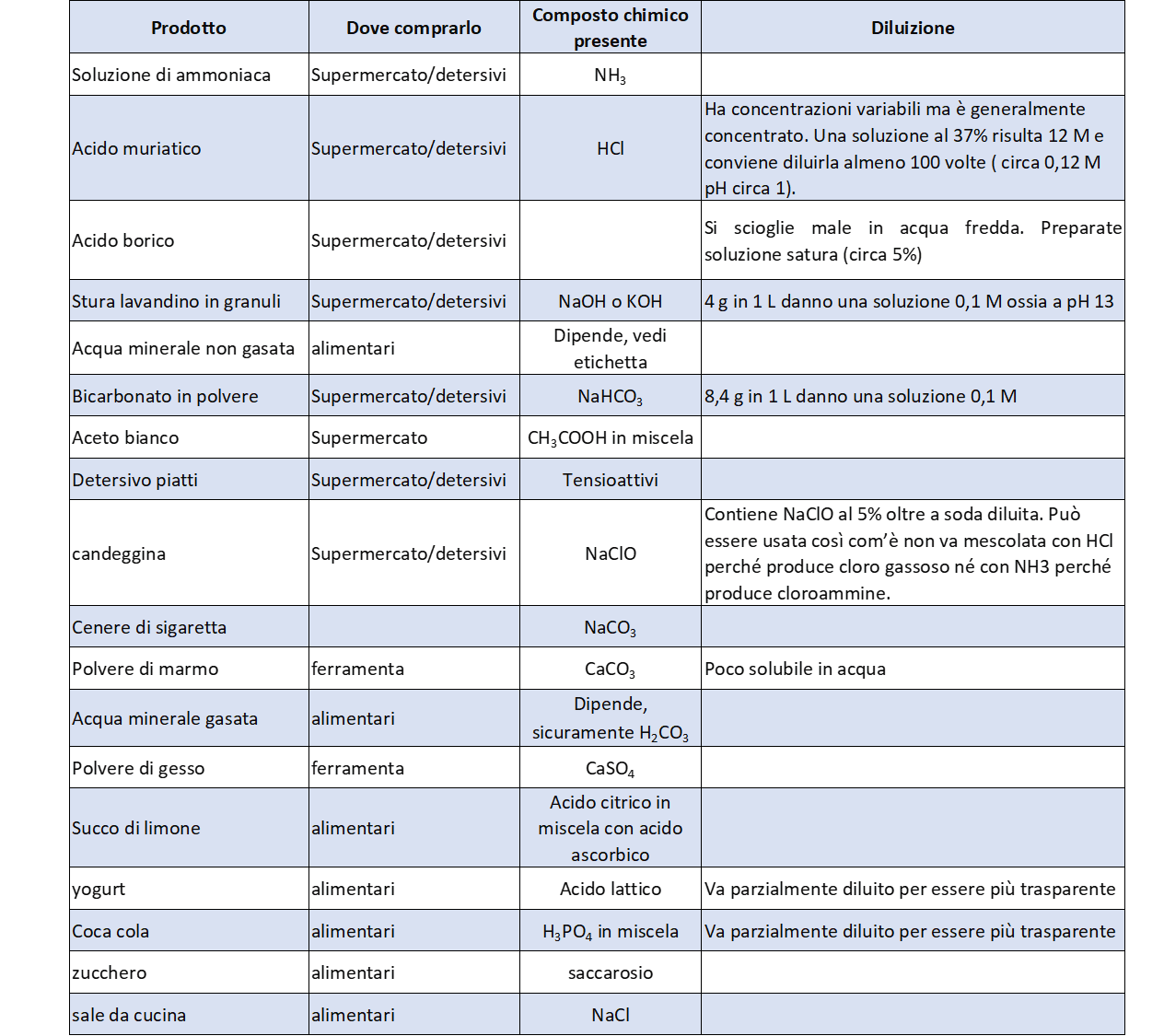
Attività di Laboratorio
a) Si danno ad ogni gruppo (3-4 persone) 4-5 soluzioni di sostanze di uso comune, di cui una che sia nota essere un acido (es. succo limone, aceto, o acido muriatico) e le si faranno suddividere ciascuna in 2 provette. Ad ogni gruppo verrà dato un indicatore, fra i tre in dotazione, e alcune cartine imbibite con il succo di cavolo rosso (precedentemente preparate).
Per ogni sostanze si aggiungerà, nella prima provetta qualche goccia di indicatore mentre la seconda provetta verrà usata per controllare la colorazione della cartina imbibita con l’estratto di cavolo rosso, facendo percolare sulla stessa, con una pipetta, qualche goccia di soluzione.
b) si chiederà ad ogni gruppo di studenti di scegliere una delle cinque soluzioni e diluirla di 10, 100, 1000 volte in tre provette e di controllare anche per queste la colorazione con gli indicatori (unicamente con l’indicatore al cavolo rosso).
c) si farà aggiungere a tutte le sostanze esaminate del bicarbonato, annotare l’eventuale effervescenza e ricontrollare il colore dell’indicatore di cavolo rosso dopo scomparsa della stessa.
d)si farà aggiungere a tutte le sostanze circa la stessa quantità di acido cloridrico 0,1 M e ricontrollare il colore dell’indicatore di cavolo rosso dopo l’aggiunta, annotando eventuali fenomeni (effervescenza, intorbiimento ecc.).
.png)
Tutti i dati ottenuti dovranno essere scritti da ciascun studente in una apposita tabella nel suo quaderno di laboratorio.
Discussione
Una volta completata l’attività sperimentale si intavolerà una discussione sui risultati ottenuti.
Si scriverà quindi una tabella generale sulla lavagna (o LIM) in cui ogni gruppo riporterà i dati ottenuti in modo da conoscere la colorazione di una sostanza in presenza di tutti gli indicatori in dotazione.
Si chiederà a questo punto agli studenti se sono in grado di suddividere le sostanze in acide, neutre o basiche in funzione delle risposte degli indicatori.
Ovviamente con le conoscenze a disposizione dei ragazzi, è impossibile dividere gli acidi dalle basi ma al massimo si possono dividere le sostanze in funzione di un analogia di comportamento (colorazione) con gli indicatori.
Facendo delle asserzioni dovute a conoscenze pregresse (per esempio si sa che il succo di limone è acido!!) e confrontando i colori riscontrati con gli indicatori, gli studenti potranno dividere le sostanze acide e neutre note(si sa che l’acqua è neutra!) dalle altre. Queste avranno per la maggior parte colorazioni uguali degli indicatori. Si noterà però che anche sostanze di cui non sono note le caratteristiche acide, hanno uguale comportamento cromatico con gli indicatori…..avremo scoperto altri acidi!!
Si chiederà quindi agli studenti se tutte le sostanze acide trovate hanno reagito con il bicarbonato.
Ovviamente, chi più chi meno tutte avranno dato reazione acido-base e la colorazione, dopo la reazione potrebbe essere cambiata o no a seconda della quantità di acido presente e della sua forza.
Si può dedurre che tutti gli acidi reagiscono con il bicarbonato….ma potrebbero esserci altre sostanze che hanno reagito col bicarbonato…per esempio acidi deboli (es. acido borico) che non hanno dato le stesse colorazioni con tutti gli indicatori…..abbiamo esteso la classe degli acidi attraverso un concetto di reattività!
Infine si può anche dedurre che due acidi mescolati tendono a mantenere la stessa colorazione dell’indicatore mentre mescolati con le altre sostanze la cambiano. Infatti mentre tutti gli acidi hanno reagito con bicarbonato alcune sostanze non hanno cambiato la colorazione (sostanze fortemente basiche) ed altre hanno virato verso il colore della soluzione di bicabonato stessa (sostanze neutre).
Analogamente se agli acidi viene aggiunto HCl le colorazioni non cambiano, mentre alcune sostanze reagiscono (basi) e altre virano alle colorazioni degli acidi.
Evidenziando a questo punto che la soda (facendo in modo che questa sia presente in qualche gruppo) è una base, si potrà definire, per confronto l’acidità o basicità di tutti i composti considerati attraverso un discorso puramente operativo funzione della reattività con il bicarbonato o con l’acido cloridrico e delle risposte coloriche ottenute dagli indicatori.
Si cercherà infine di scrivere una scala comune sopra la quale rappresentare tutti i composti indirizzando gli studenti a posizionare gli acidi e le basi all’estremità della scala.
E’ importante evidenziare che la classificazione fatta non dipende dalla sostanza in toto ma è una proprietà comune di sostanze anche molto diverse fra loro (si pensi a bicarbonato e soda caustica visibilmente differenti o aceto e limone). I primi studi sistematici in chimica andavano avanti per categorizzazioni analizzando il mondo reale e tentando di classificare i composti in base alle loro proprietà operative. Ciò può essere un approccio per stimolare gli studenti a considerare le sostanze chimiche come se fossero formate da varie parti. La tendenza di sostanze diversi a reagire allo stesso modo deve essere quindi sintomi della presenza di parti uguali nelle sostanze analizzate. Tutto ciò avrà permesso di dare una definizione operativa dell’acidità e della basicità senza spiegare il fenomeno chimico alla base e può essere usato come introduzione alla teoria di Arrhenius.
Per ampliare l’argomento bisogna comprendere cosa fa sì che tutti gli acidi si comportino allo stesso modo. Questo verrà fatto nella esperienza successiva.
Bibliografia
- F Bagatti, E. Corradi, A. Desco, C. Ropa “Chimica” Ed. Zanichelli, 2000;
- G. Benvenuto “Verifica processi formativi” Ed. Nuova Cultura;
- http://www.treccani.it/enciclopedia/acidi-e-basi_(Enciclopedia_dei_ragazzi)/;
- http://www.treccani.it/enciclopedia/acido/;
- http://www.funsci.com/fun3_it/acidi/acidi.htm.
Autori
Tofani Daniela
Schede / Allegati
Prove di verifica
Specifiche esperimentoMateria Chimica Classi a cui è rivolto 1° biennio Tipologia di laboratorio Povero Reperibilità del materiale Uso quotidiano, negozi specializzati, siti web Materiale specifico Indicatori metilarancio, fenolftaleina, rosso fenolo Durata esperimento in classe 2 h Capacità di bricolage/assemblaggio No Necessità lavorazioni meccaniche/elettroniche No Necessità PC per acqusizione/analisi dati No Necessità di uno smartphone No Parole chiave Chimica Reattività delle molecole Acidi e basi Indicatori di pH |