Riassunto / Abstract
Preparazione di un indicatore universale di pH utilizzando l’estratto di foglie di cavolo rosso.
Scheda sintetica delle attività
- La preparazione dell’indicatore al cavolo rosso può essere condotta a casa o in laboratorio.
- Si estraggono le antocianidine del cavolo bollendolo lo foglie sminuzzate con acqua calda (o alcol puro a freddo).
- La soluzione filtrata può essere usata direttamente nelle soluzioni delle quali si vuole determinare il pH.
- Se si immergono nella soluzione delle striscioline di carta assorbente e si lasciano asciugare, si ottengono delle cartine tornasole di facile utilizzo.
Risorse necessarie
- Foglie di cavolo rosso;
- 1 pentolino;
- 200 mL di acqua distillata (o 200 mL di etanolo alimentare);
- 1 colino;
- 1 imbuto;
- 1 bottiglietta di vetro con tappo;
- 1 foglio di carta assorbente;
- 1 bicchiere;
- 1 pinzetta;
- 1 forbice.
Prerequisiti necessari
Minime capacità di lavorare con soluzioni calde.
Obiettivi di apprendimento
- Capacità di comprendere il concetto di estrazione a caldo;
- capacità di preparare un estratto naturale.
Dotazioni di sicurezza
L’alcool etilico puro (si vende nei supermercati per fare liquori) è volatile e infiammabile. E’ buona norma usarlo lontano da fiamme. Per le schede di sicurezza vedi sito: http://host.uniroma3.it/centri/cisdic/sicurezza.htm.
Svolgimento
Questa attività è molto semplice e potrebbe essere proposta come lavoro da fare a casa o in laboratorio prima di una esperienza su acidi e basi (vedi esperimento 10-Scienze). Nella sezione delle schede è presentata la ricetta da dare agli studenti.
Procedimento
- Si devono tagliare a pezzetti una o due (dipende dalle dimensioni) foglie di cavolo rosso.
- Si mettono i pezzi in un pentolino e si aggiungono circa 200 mL di acqua.
- Si pone sul fuoco e arrivati al punto di ebollizione si lascia per 20 minuti a sobbollire.
- Se si usa alcol etilico puro si deve lasciare macerare le foglie a temperatura ambiente per alcune ore.
- Si filtra la soluzione su un colino (preferibilmente di plastica) e si percola attraverso un imbuto in una bottiglia di vetro con tappo. La soluzione è stabile per parecchio se tenuta in frigorifero. La soluzione etanolica è più stabile e dura molti mesi in frigorifero
- Se si desidera preparare delle cartine indicatrici con la soluzione di cavolo si riempie un bicchiere di vetro con parte della soluzione e vi si immergono delle striscioline di carta assorbente larghe 1 cm e lunghe 5 cm preventivamente ritagliate dal foglio di carta.
- Si prelevano le striscioline umide e si lasciano seccare all’aria su un piano pulito ed asciutto, possibilmente di materiale inerte (plastica, melamminico) o su un piatto.
- Una volta ben asciutte le striscioline vanno conservate in una scatolina al buio, in luogo fresco e non umido.
Discussione
Le antocianidine sono coloranti organici complessi prodotti dalle piante. Sono dei flavonoidi che legati a molecole di zucchero formano le antocianine, pigmenti vegetali solubili in acqua. Hanno varie colorazioni (generalmente rosse, arancio e viola) e spesso sono presenti nei petali come colorazione attrattiva per gli insetti. Assorbendo nella zona del visibile e dell’ultravioletto, hanno azione protettiva dai raggi ultravioletti per le foglie, gli arbusti e soprattutto i nuovi virgulti che infatti ne contengono quantità superiori alla norma.
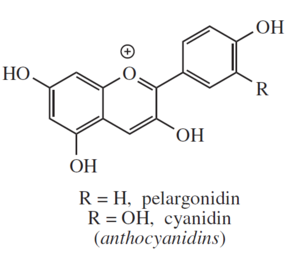
Alla base del processo utilizzato vi è la dissoluzione delle antocianidine presenti all’interno delle foglie di cavolo, in acqua calda (o etanolo). Volendo utilizzare questa preparazione per intavolare una discussione con gli studenti si può procedere facendo fare in contemporanea, l’estrazione con acqua fredda, acqua calda, etanolo ed etilacetato.
Sarà così interessante far loro notare che:
- se si mettono i pezzettini di cavolo in acqua fredda le sostanze colorate presenti passeranno in soluzione molto lentamente.
- Lo stesso processo condotto con un solvente più apolare come l’etanolo avviene più velocemente.
- L’uso di etilacetato ancora più apolare facilita ulteriormente il processo di dissoluzione.
- Il riscaldamento della soluzione acquosa facilita il passaggio dei coloranti in acqua sia perché rompe le pareti cellulari sia perché aumenta la solubilità delle sostanze.
Tutto ciò può essere usato per introdurre il concetto di affinità fra sostanze simili ed estrazione con solventi.
Bibliografia
- F. Bagatti, E. Corradi, A. Desco, C. Ropa “Chimica” Ed. Zanichelli, 2011;
- per la definizione di indicatore vedi: http://www.treccani.it/enciclopedia/indicatori_res-0ee30998-87e6-11dc-8e9d-0016357eee51_(Enciclopedia-Italiana)/#indicatoridineutralizzazione-1
- http://it.wikipedia.org/wiki/Indicatore_(chimica)
- per approfondimenti su antociani ed antocianidine vedi: http://it.wikipedia.org/wiki/Antociani
- per l’uso degli indicatori di pH e la preparazione dell’indicatore con cavolo rosso vedi: http://www.funsci.com/fun3_it/acidi/acidi.htm
Autori
Tofani Daniela
Schede / Allegati
Riassunto / Abstract
Specifiche esperimentoMateria Chimica Classi a cui è rivolto 1° biennio Tipologia di laboratorio Povero Reperibilità del materiale Uso quotidiano, negozi specializzati, siti web Materiale specifico Cavolo rosso, pentola, coperchio, sistema di riscaldamento, bottiglia Durata esperimento in classe 1 h Capacità di bricolage/assemblaggio No Necessità lavorazioni meccaniche/elettroniche No Necessità PC per acqusizione/analisi dati No Necessità di uno smartphone No Parole chiave Chimica Reattività delle molecole Acidi e basi Indicatori di pH |