Attraverso una serie di semplici attività di laboratorio si mette in evidenza l’importanza dell’energia luminosa nell’ambito del processo fotosintetico e la necessità delle presenza della clorofilla per lo svolgimento del processo . Si passa quindi a localizzare la clorofilla nei cloroplasti e si dimostra che le piante il “nutrimento” non lo trovano nel terreno . Gli studenti infine progetteranno degli esperimenti per valutare l’influenza di vari fattori sulla velocità di svolgimento della fotosintesi e potranno effettuare una misura indiretta del processo fotosintetico stesso.

Scheda esperimento
| Classi | 2° biennio |
| Tipologia | Strumentazione semplice |
| Durata | 10 h |
 |  |  |  |
Scheda sintetica delle attività
Il percorso verrà svolto secondo la metodologia Inquiry Based Science Education (IBSE) o Inquiry Based Learning (IBL), l’approccio pedagogico basato sull’investigazione, che stimola la formulazione di domande e azioni per risolvere problemi e capire fenomeni. Questo metodo prevede una sequenza di fasi innovativa rispetto ai consueti modi di fare lezione poiché gli studenti si confrontano con l’oggetto di studio (osservazione di un fenomeno , variabili in gioco, strumenti di misura …), si pongono domande, formulano ipotesi, le verificano attraverso esperimenti e ne discutono i risultati.
Per l’applicazione di questo metodo in classe si adotta il 5E Model programmando l’attività attraverso le seguenti fasi: Engagement, Explore, Explain, Elaborate, Evaluate.
Engagement
L’attività inizia sempre con l’osservazione di un fenomeno inquadrabile tra i temi del percorso didattico, su cui gli studenti sono invitati a riflettere e a porsi domande oppure con una domanda “ad hoc” dell’insegnante. In questa fase gli studenti sono lasciati liberi di esprimere le proprie opinioni e osservazioni, sarà compito dell’insegnante raccogliere quelle più significative ai fini dell’esperienza. Questa fase ha il compito di attirare l’attenzione, stimolare la curiosità, indurre nello studente la sensazione di “volerne saperne di più”. È la fase in assoluto più importante, perché dalla sua buona organizzazione deriva la riuscita dell’intero percorso di apprendimento.
Explore
Una volta raccolte le domande su ciò che si desidera indagare, si indirizzano gli studenti verso la fase sperimentale, chiedendo loro di ideare un esperimento che possa dare delle risposte. È importante che l’insegnante sia pronto a ricevere suggerimenti e proposte anche dagli studenti che intendano sperimentare il fenomeno in modo diverso, affiancando tali idee a quelle del modulo. È fondamentale che gli studenti identifichino le variabili in gioco e le sperimentino. Lo scopo di questa fase è registrare dati, isolare variabili, creare grafici e analizzare i risultati.
Explain
Gli studenti vengono introdotti a modelli, leggi e teorie. Si fornisce il vocabolario corretto, che permetta loro di spiegare in modo scientificamente rigoroso i risultati delle loro esplorazioni, stimolando la ricerca autonoma sul contesto studiato.
Elaborate
Gli studenti elaborano quanto hanno scoperto nelle fasi precedenti applicandolo ad altre situazioni che possano fare emergere nuove domande e ipotesi da esplorare. Gli studenti dovrebbero raggiungere il trasferimento dell’apprendimento (transfer of learning).
Evaluate
L’ultima fase prevede la realizzazione di un prodotto finale che sarà valutato mediante autovalutazione, valutazione dei membri del proprio gruppo e valutazione da parte dell’insegnante. Il prodotto finale potrà essere discusso in vario modo: davanti agli insegnanti e ai ricercatori, in un’occasione apposita, inquadrabile in una giornata della Scienza, in una mostra o altro.
È importante sottolineare che le fasi previste dall’IBSE non sono da considerarsi obbligatoriamente consecutive e che ci sono vari livelli di Inquiry in relazione all’età e alla preparazione degli alunni.
Il percorso ” La foglia al lavoro: la fotosintesi clorofilliana” prevede lo svolgimento di varie attività che rispondono ad una serie di domande attraverso le quali gli studenti indagano il fenomeno oggetto di studio al fine di :
Attività n °l Dimostrare che le piante abbisognano di luce
Attività n°2 Dimostrare che non è il terreno il nutrimento principale delle piante
Attività n°3 Dimostrare la presenza di amido nelle foglie
Attività n°4 Dimostrare che solo le parti verdi di una foglia compiono la fotosintesi
Attività n°5 Dimostrare la presenza di pigmenti diversi nelle foglie verdi e loro separazione mediante cromatografia su carta
Attività n° 6 Dimostrare la presenza della clorofilla nelle foglie bronzate
Attività n°7 Verificare la fluorescenza della clorofilla
Attività 7 bis Effettuare un’ Analisi spettrofotometrica
Attività 8 Localizzare dove si trova la clorofilla.
Attività n°9 Indagare quali fattori influenzano la velocità della fotosintesi
Attività 9 bis Effettuare una misura indiretta della velocità della fotosintesi
Risorse necessarie
Attività n. l – Dimostrare che le piante abbisognano di luce
Semi di fagiolo o di zucca o di altre piante a rapida germinazione e accrescimento, vaschette, cotone idrofilo o carta da filtro, due scatoloni di cartone di cui uno con un foro, vasetti
Attività n. 2 – Dimostrare che non è il terreno il nutrimento principale delle piante
Bilancia, patate o semi, terriccio, vaso, Stufa
Attività n. 3 – Dimostrare la presenza di amido nelle foglie Piantine dell’esperimento l, fornello elettrico (non a gas!), alcool 95°, soluzione iodio iodurata, becher da 500ml e da l50ml, pipette, scatola petri, pinzette, lametta – becher grande
Attività n. 4 – Dimostrare che solo le parti verdi di una foglia compiono la fotosintesi
Pianta verde in vaso (Impatiens), pianta con foglie eziolate, Elodea canadensis, alghe verdi, tappo di sughero, spilli, fornello elettrico (non a gas!), alcool 95°, soluzione iodio iodurata, becher da 500ml e da l50ml, pipette, scatola Petri, pinzette, lametta, becher grande.
Attività n. 5 – Dimostrare la presenza di pigmenti diversi nelle foglie verdi e loro separazione mediante cromatografia su carta
Foglie verdi (bietole, spinaci), alcool a 95°, carta da cromatografia o carta da filtro, pipette Pasteur, recipiente di vetro (con tappo al cui fondo va inserito un gancetto al quale appendere la striscia di carta), eluente (acetato di etile)
Attività n. 6 – Dimostrare la presenza della clorofilla nelle foglie bronzate
Alcune foglie bronzate (Coleus sp., Iresine sp, impatiens) capsula Petri, etanolo fornelletto, provetta, petrolio bianco, pipetta, Quaderno dello studente, Computer, stampante
Attività n. 7 – Verificare la fluorescenza della clorofilla
Provetta con estratto di clorofilla, fonte di luce oppure spettrofotometro
Attività n. 7 bis – Analisi spettrofotometrica
Spettrofotometro oppure si può utilizzare un cellulare come descritto al link http://gifh.wordpress.com/2010/10/09/come-trasformare-un-cellulare-in-uno-spettrofotometro/
Attività 8 – Dove si trova la clorofilla?
Foglie di Elodea, vetrini portaoggetto e copri oggetto, pinzette, ago manicato, acqua, microscopio ottico.
Attività n°9 – Quali fattori influenzano la velocità della fotosintesi?
Elodea, siringa (20ml), acqua, capillare di vetro (30 cm), morsetto, sostegno, luce
Attività 9 bis – Misura indiretta della velocità della fotosintesi
300 ml soluzione di bicarbonato di sodio allo 0,2% (circa 1/8 di un cucchiaino da tè di bicarbonato in 300 ml d’acqua) e aggiungere una goccia di sapone liquido che, bagnando la superficie idrofobica della foglia, permetterà alla soluzione di penetrare al suo interno.
Con una perforatrice per fogli, tagliare 20 dischetti da una foglia (i dischetti avranno all’incirca un diametro di 5 mm), forandola lontano dalla nervatura centrale: dieci per il gruppo sperimentale e altrettanti per il gruppo di controllo. La foglia da utilizzare deve essere liscia, non pelosa e non troppo spessa ( si possono per esempio usare foglie di spinaci).
siringa (preferibile da 50cc), bicchiere di plastica trasparente, cronometro, lampada (fonte di luce), carta millimetrata, matite e righello.
Prerequisiti necessari
Flusso di energia nell’ecosistema;
anatomia della foglia;
reazioni esoergoniche ed endoergoniche;
principali composti organici;
cellula vegetale;
saper usare il M.O.;
saper utilizzare tecniche di separazione.
Obiettivi di apprendimento
- Riconoscere che la luce è necessaria per produrre zuccheri e amidi;
- riconoscere che il pigmento verde chiamato clorofilla è necessario per produrre zuccheri e amidi;
- saper spiegare che le varietà di piante con foglie bronzate contengono clorofilla così come le piante con foglie verdi;
- saper spiegare che la pianta non si procura il “cibo” dal terreno;
- individuare quali variabili influenzano la velocità della fotosintesi.
Dotazioni di sicurezza
- E’ necessario utilizzare i dispositivi di sicurezza individuali: cappa chimica aspirante, camice, guanti, occhiali.
Occorre prestare attenzione all’uso di:
- Acetato di Etile: Facilmente infiammabile. Conservare lontano da fiamme e scintille. Non fumare. Non respirare i vapori. Non gettare i residui nelle fognature. Evitare l’accumulo di cariche elettrostatiche.
- Alcol etilico 95° Facilmente infiammabile. Liquido e vapori facilmente infiammabili: conservare lontano da fiamme e scintille , nell’uso evitare l’accumulo di vapori tenendo aperte porte e finestre e assicurando una ventilazione incrociata.
Riutilizzare, se possibile. I residui del prodotto sono da considerare rifiuti speciali pericolosi. La pericolosità dei rifiuti che contengono in parte questo prodotto deve essere valutata in base alle disposizioni legislative vigenti. Lo smaltimento deve essere affidato ad una società autorizzata alla gestione dei rifiuti, nel rispetto della normativa nazionale ed eventualmente locale.
Evitare assolutamente di disperdere il prodotto nel terreno, in fognature o corsi d’acqua - Soluzione iodio iodurata: Nocivo per inalazione e contatto con la pelle. Irritante per gli occhi, le vie respiratorie e la pelle. Indossare guanti da lavoro in PVC e occhiali protettivi ermetici. Mantenere ben areato il locale di lavoro.
I residui del prodotto sono da considerare rifiuti speciali pericolosi. La pericolosità dei rifiuti che contengono in parte questo prodotto deve essere valutata in base alle disposizioni legislative vigenti. Lo smaltimento deve essere affidato ad una società autorizzata alla gestione dei rifiuti, nel rispetto della normativa nazionale ed eventualmente locale.
Evitare assolutamente di disperdere il prodotto nel terreno, in fognature o corsi d’acqua - Etere di Petrolio: Facilmente infiammabile. Nocivo: pericolo di gravi danni per la salute in caso di esposizione prolungata per inalazione. Conservare il recipiente in luogo ben ventilato. Conservare lontano da fiamme e scintille – Non fumare. Non respirare i vapori. Evitare il contatto con la pelle. Evitare l’accumulo di cariche elettrostatiche. In caso di incendio, usare sabbia, carbono diossido o polvere secca. Non usare mai acqua. In caso di ingestione non provocare il vomito: consultare immediatamente il medico e mostrargli il contenitore o l’etichetta.
- Acetone: Facilmente infiammabile. Conservare il recipiente in luogo ben ventilato. Conservare lontano da fiamme e scintille – Non fumare. Non respirare i vapori. Evitare l’accumulo di cariche elettrostatiche.
Per le schede di rischio in ordine alfabetico vedi il sito seguente http://www.zetalab.it/schede/schedeA.html.
Svolgimento
Introduzione
Uno dei fattori ambientali più importanti per la crescita e sviluppo di una pianta è la luce. La luce viene utilizzata dalle piante non solo come fonte di energia chimica, attraverso la fotosintesi, ma anche come segnale ambientale che regola la crescita e lo sviluppo. La luce, come segnale ambientale, viene percepita dalla pianta mediante specifici recettori (fotorecettori). Le piante, per riceverla vanno incontro a evidenti modifiche morfogenetiche :in condizioni di illuminazione unidirezionale, la pianta cresce in direzione della sorgente luminosa (risposta fototropica). Le piante fatte crescere in assenza di luce (situazione che simula la crescita ipogea) sono esili, di colore chiaro ( bianco – giallo pallido) perché prive di pigmenti fotosintetici completi, e molto allungate: questo fenomeno fisiologico, frutto dell’adattamento evolutivo, porta il “germinello” ad accrescersi velocemente, consumando le riserve presenti nel seme, per raggiungere la superficie del terreno
Il pattern di sviluppo delle piante alla luce è detto Fotomorfogenesi
Il pattern di sviluppo delle piante al buio (eziolato) è detto Scotomorfogenesi:
Attività n°1 – Dimostrare che le piante abbisognano di luce
Si fodera una vaschetta di vetro con carta assorbente o cotone idrofilo, si pongono almeno una dozzina di i semi ( fagioli, lenticchie, cicerchie, lino, ……) ben distribuiti e si innaffia quotidianamente il “germinatoio”.
Quando le pianticelle si saranno formate, si trapiantano in vasetti in cui è inserito del terriccio universale.
Poiché vogliamo indagare l’influenza della luce sullo sviluppo e la crescita delle pianticelle, manteniamo costanti le altre variabili ambientali (terreno, temperatura e umidità ) e poniamo alcuni vasetti entro uno scatolone completamente al buio, altri in uno scatolone in cui è stato praticato un foro e altri alla luce.
Dopo alcuni giorni potremo osservare la crescita delle pianticelle : ripetiamo le osservazioni periodicamente, per almeno 15-20 giorni
Alla fine dell’esperimento gli allievi avranno notato che:
le piante alla luce sono cresciute normalmente e le foglie sono verdi;
le piante poste nello scatolone al buio sono allungate, di un colore bianco -giallo pallido (scotomorfogenesi);
le piante poste nello scatolone col foro sono piegate verso la luce (fototropismo).

Conclusione : la luce è necessaria per lo sviluppo e la crescita regolare della pianta, quando la fonte di luce è unidirezionale la pianta si piega nella direzione della luce (fototropismo) mentre in assenza di luce si osservano pianticelle esili, molto allungate e prive di colorazione verde (scotomorfogenesi).
Attività n°2 – Dimostrare che non è il terreno il nutrimento principale delle piante
Molti ragazzi credono che le piante si procurino il nutrimento di cui hanno bisogno dal terreno e alcune pubblicità contribuiscono ad alimentare questo errore, sottolineando il fatto che le piante hanno bisogno di fertilizzanti per crescere bene. E’ vero che le piante assorbono piccole quantità di minerali dal suolo, ma questi non costituiscono il nutrimento principale delle piante.
Questo è un nodo concettuale di fondamentale importanza sul quale è bene insistere (N.B. sarebbe bene fin dalla scuola primaria per evitare il radicarsi di errori, difficili da superare anche nei cicli scolastici superiori)
Per dimostrare che non è il terreno la fonte principale di nutrimento delle piante può essere utile piantare delle patate in un grande vaso pieno di terra. Si possono utilizzare le cosiddette patate da semina, cioè i tuberi che abbiamo in casa e che germogliano (se sono troppi grandi possono essere tagliati longitudinalmente avendo cura che nelle due metà siano presenti i germogli). Il terreno ideale per la coltivazione dovrebbe essere ben drenato e con un pH acido, possibilmente inferiore a 5, ed essere esposto alla luce e innaffiato regolarmente.
Dopo aver pesato ciascun vaso, ciascun tubero e il terriccio, metteremo un tubero per vaso ad una profondità di circa otto centimetri ricoprendo successivamente il tutto con la terra, che però va solo riposata e non pressata, in modo da non ostacolare la crescita delle piante . Peseremo quindi il sistema vaso, terriccio tubero prima di innaffiare (innaffiatura con dosatore in modo da fornire sempre la stessa quantità di acqua). Con il passare del tempo le piantine inizieranno a crescere e allora potremo accumulare della terra attorno al gambo delle patate e poi procedere con la creazione di un piccolo solco che servirà per l’irrigazione. Per seguire il percorso di sviluppo della patata, occorrono diversi mesi: se avete piantato le patate nel periodo compreso tra settembre e ottobre, i nuovi tuberi si formeranno verso febbraio e cresceranno di dimensione fino a maggio. Il vaso sarà pesato periodicamente, prima dell’annaffiatura, per verificarne le variazioni . Per capire quando raccogliere si possono osservare le piantine: se sono secche è possibile iniziare la raccolta. Poiché il peso del terreno e degli organi vegetali è fortemente influenzato dal grado di idratazione, una volta raccolte le patate metteremo in stufa a 70 °C , sia le patate che il terreno, per avere una stima delle variazioni di peso secco.
Per rendere l’attività più contenuta nel tempo anziché usare le patate si possono usare dei semi di fagioli, o di un altra pianta a rapida crescita. Dopo aver pesato il terreno si mette dentro un vaso in cui mettiamo a germinare un seme precedentemente pesato. Quando si sarà formata la piantina si peserà separatamente pianta e terreno giungendo a notare che, mentre il terreno pesa circa lo stesso peso, la piantina ha un peso molto superiore di quello del seme.
Conclusione : Il nutrimento principale delle piante non è il terreno perciò deve essere un altro.
Si può far notare che le piante sono organismi viventi e che perciò hanno bisogno delle stesse sostanze, definite sostanze organiche, che mangiamo noi, ma le piante riescono a produrle da sole.

Attività n°3 – Dimostrare la presenza di amido nelle foglie
Prima di procedere è necessario fare notare cosa succede quando mettiamo della soluzione di iodio a contatto con l’amido (reazione di confronto).
Si prende della salda d’amido la si scioglie in acqua ,si aggiunge qualche goccia della soluzione di iodio. Si nota che il colore cambia (blu violetto nero ).
Per un test di confronto prendere dello zucchero e aggiungere qualche goccia di iodio: fare osservare la diversa colorazione.
Staccare una foglia dalle piantine cresciute al buio (foglia1) e una dalle piantine cresciute alla luce (foglia 2).
In un becher da 500 ml fare bollire acqua distillata, immergere la foglia l e lasciarla bollire 2-3 minuti.
In un becher da 500 ml fare bollire acqua distillata, immergere la foglia 2 e lasciarla bollire 2-3 minuti (questo procedimento consente di rompere le pareti cellulari e fermare i processi biochimici).
Togliere le foglie dall’acqua e immergerle ciascuna in un becher piccolo contenente l0 ml di alcol a 95° e far bollire la soluzione a bagnomaria per l0 minuti circa, fino a quando la foglia sarà completamente decolorata (questo procedimento fa sì che i pigmenti vengano portati in soluzione).
Togliere le foglie dall’alcool e stenderle con attenzione sul coperchio di una scatola Petri.
Versare la soluzione iodo iodurata sulla foglia ben stesa e osservare (la soluzione iodo iodurata, liquido di Lugol, è un indicatore che cambia colore da giallo oro/marrone a blu viola scuro o nero in presenza di amidi, come dimostrato all’inizio dell’attività).

Nota: se non si possiede un bagnomaria si può procedere al riscaldamento diretto ma bisogna fare molta attenzione a evitare fenomeni di surriscaldamento: questi avvengono quando un liquido raggiunge una temperatura superiore al proprio punto di ebollizione e improvvisamente evapora in maniera violenta, rappresentando una potenziale fonte di ustioni. Per evitare questo rischio usare una capsula Petri poco profonda e mescolare frequentemente la soluzione di etanolo
Far esporre ai ragazzi quello che hanno osservato, spiegandone il significato. Apparirà chiaro che solo la foglia della pianta cresciuta alla luce contiene amido.
Qualcuno potrebbe obiettare che le foglie sono prese da piante diverse e perciò hanno dato risultati diversi.
Attività n°4 – Dimostrare che solo le parti verdi di una foglia compiono la fotosintesi
Parte A
- Tagliare, con la lametta, due dischetti dal tappo di sughero;
- scegliere una foglia ben sviluppata e, senza staccarla, chiuderne un lembo tra i due dischetti di sughero fermati con gli spilli (figura 4);
- lasciare per 3-4 giorni la pianta in luogo luminoso e riscaldato;
- trascorso il periodo, staccare la foglia, privarla dei dischetti di sughero e proseguire come nell’esperimento precedente.
- Ripetere l’esperimento precedente utilizzando una foglia eziolata o variegata.
Risultati: sulla stessa foglia la parte coperta dai dischetti non ha prodotto amido, la foglia variegata presenta la colorazione violacea solo nelle parti più scure dove c’è maggior concentrazione di clorofilla (figura 5).


Attività n°5 – Dimostrare la presenza di pigmenti diversi nelle foglie verdi e loro separazione mediante cromatografia su carta
La cromatografia è un ottimo sistema di separazione.
- Tagliare a pezzetti alcune foglie verdi e pestarle in mortaio assieme ad alcuni millilitri di alcol a 95° fino a ridurle in poltiglia;
- lasciare decantare e filtrare il liquido verde sopranatante in una provetta;
- con la pipetta di Pasteur deporne alcune gocce sulla linea di base, tracciata precedentemente a 2 cm dal fondo di un foglio di carta da filtro (fare attenzione che le gocce non si espandano troppo);
- immergere la carta da filtro in un recipiente sul cui fondo è contenuta la soluzione eluente (l’eluente deve rimanere al di sotto del punto di caricamento della soluzione verde o potrebbe essere necessario appendere la carta al tappo del recipiente);
- chiudere il recipiente e attendere che l’eluente giunga a circa l cm dal bordo superiore la separazione dei pigmenti è resa possibile dall’azione del solvente (fase mobile) che per capillarità trascina i componenti della miscela sulla carta da cromatografia (fase fissa);
- togliere la carta da filtro ed osservare quattro bande colorate dall’alto verso il basso che indicheranno i quattro pigmenti presenti: carotene (giallo dorato), xantofilla (giallo), clorofilla a (blu – verde), clorofilla b (giallo – verde).
L’eluente è salito lungo la striscia per mezzo della capillarità, trascinando i vari pigmenti (figura 6) con diversa velocità a seconda della loro affinità per la fase mobile (eluente) rispetto alla fase fissa (carta idratata)

Attività n° 6 – Dimostrare la presenza della clorofilla nelle foglie bronzate (ad esempio foglie di Tradescandia rossa, di Coleus sp., di Impantiens, cavolo rosso ecc.)
Fare a pezzettini le foglie bronzate e mettetele in una capsula Petri con l’etanolo, operazione che serve ad accelerare il processo.
fare lo stesso anche con delle foglie verdi (esperimento di controllo).
scaldare l’etanolo e non appena giunge a bollore spegnere il fornelletto. Dopo un po’ di tempo l’alcol diventa rosso: questo è dovuto alla presenza di antociani (o antocianine), pigmenti vegetali responsabili del colore rosso delle foglie bronzate, che sono passati in soluzione ( estrazione in etanolo).
Usando una pipetta, trasferire il liquido rosso in una provetta, riempiendola fino a metà.
Usando un’altra pipetta aggiungere del petrolio bianco riempiendo la provetta fino a tre quarti del suo volume.
Chiudere la provetta e agitarla finché petrolio bianco ed etanolo si mescolino ben bene
Dopo alcuni secondi i due liquidi cominciano a separarsi di nuovo: il petrolio oleoso galleggia e l’etanolo resta in basso. Si può osservare che il petrolio bianco è diventato verde e galleggia sull’etanolo rosso (figura 7).

Poiché i due solventi (Petrolio bianco e Etanolo) sono immiscibili e la clorofilla ha maggiore affinità per il petrolio bianco rispetto all’etanolo, dopo aver aggiunto il petrolio bianco alla provetta contenente il liquido rosso ed aver mescolato accuratamente, i due liquidi successivamente si stratificano e lo strato di petrolio bianco superiore apparirà di colore verde, perché la clorofilla per maggiore affinità passa in questo strato, mentre gli antociani non affini al petrolio bianco restano in soluzione in etanolo (strato inferiore di colore rosso).
Nelle foglie bronzate la clorofilla è mascherata dal colore rosso dovuto agli antociani.
Se queste non contenessero clorofilla la pianta non potrebbe fotosintetizzare e svilupparsi.
Sicurezza :
Quando si riscaldano sostanze alcoliche come l’etanolo bisogna prestare attenzione a evitare fenomeni di super riscaldamento: questi avvengono quando un liquido raggiunge una temperatura superiore al proprio punto di ebollizione e improvvisamente evapora in maniera violenta, rappresentando una potenziale fonte di ustioni. Per evitare questo rischio si usa una capsula Petri poco profonda e si mescola frequentemente la soluzione di etanolo. Usare preferibilmente un fornelletto elettrico o un bagno termoriscaldato. Quando si usa il petrolio bianco fare attenzione: è INFIAMMABILE!
Cosa è la clorofilla?
Il processo fotosintetico si svolge all’interno dei cloroplasti, dove, a livello delle membrane dei tilacoidi, sono inseriti i complessi funzionali in grado di condurre il trasporto di elettroni della fase luminosa della fotosintesi, denominati Fotosistema II, (o PS II, da Photo System II) e Fotosistema I (o PS I, da Photo System I).
I due fotosistemi sono complicate strutture molecolari che attraversano il doppio strato lipidico delle membrane tilacoidi , e risultano formate dai complessi di pigmenti antenna, clorofille e carotenoidi, dalla clorofilla a dei centri di reazione e da alcuni trasportatori di elettroni. Tramite i pigmenti antenna l’energia viene convogliata verso una molecola trappola, (clorofilla “a“), che si trova nel centro di reazione del fotosistema.
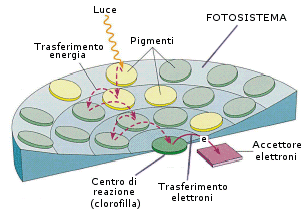
Nel fotosistema I la molecola di clorofilla a viene eccitata da una lunghezza d’onda di 700 nm, (il fotosistema è detto P700); nel fotosistema II la molecola clorofilla a viene eccitata da una lunghezza d’onda di 680 nm (il fotosistema è detto P680).
Il 99% dei fotoni assorbiti dai pigmenti antenna raggiunge il centro di reazione fotochimica. I due fotosistemi lavorano in modo integrato.
Fluorescenza della clorofilla
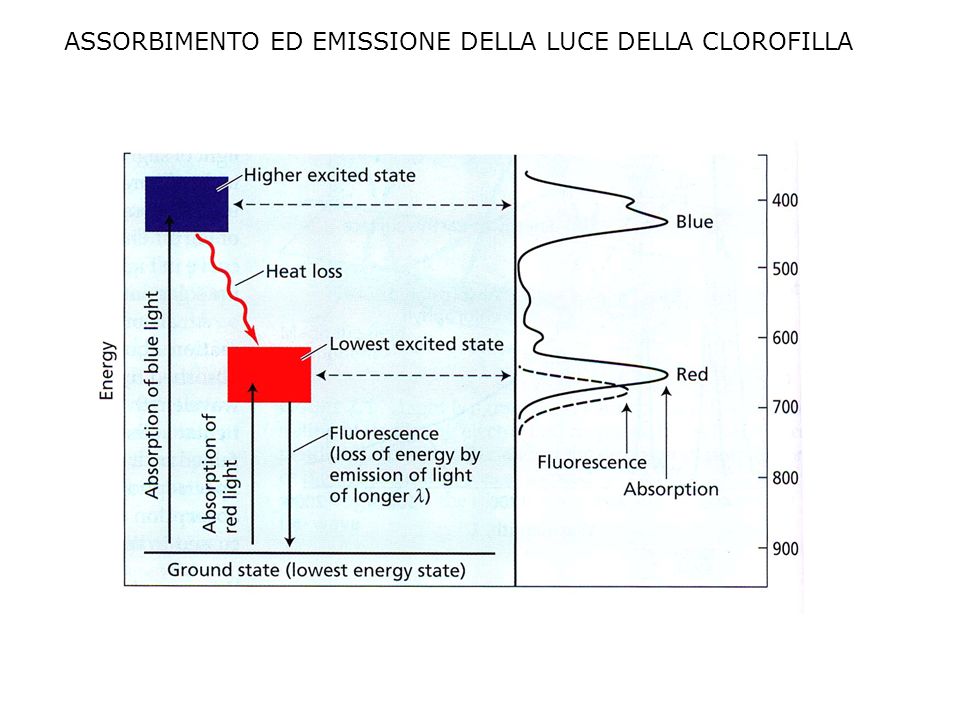
Quando i pigmenti assorbono luce, gli elettroni vengono spinti a livelli di energia superiori (orbitali molecolari più esterni). Nel caso di un fotone di luce blu che colpisca la clorofilla, un elettrone dello stato fondamentale raggiunge lo stato Sb (S sta per stato eccitato singoletto). Molto velocemente l’elettrone perde energia sotto forma di calore e raggiunge lo stato Sa ad energia più bassa (lo stesso che avrebbe raggiunto se fosse stato colpito da un fotone di luce rossa). Il pigmento eccitato può a questo punto essere coinvolto in una reazione fotochimica (riduzione di un accettore) o decadere radiativamente (vedi sotto).
La conversione dell’energia luminosa in energia chimica può avvenire solo a livello dei cloroplasti dove i pigmenti fotosintetici sono disposti nei complessi antenna in maniera tale da catturare il fotone, passare allo stato eccitato e poi cedere energia ai pigmenti vicini per risonanza fino al centro di reazione ( clorofilla a ) il quale si eccita e dona un elettrone (ossidandosi) al primo accettore (che si riduce) della catena di trasporto di elettroni (figura 8).
Il fenomeno della fluorescenza si può osservare quando illuminiamo una soluzione contenente clorofilla, perché questa, essendo in soluzione, non può utilizzare l’energia assorbita per compiere lavoro fotochimico quindi dissipa l’energia attraverso l’emissione di fotoni meno energetici di quelli assorbiti (a causa della dissipazione di energia mediante emissione di calore) e quindi con lunghezza d’onda maggiore: la clorofilla illuminata con luce bianca o blu emette infatti fluorescenza nel rosso (figura 9).I colori dei pigmenti sono il risultato dell’assorbimento dell’energia e della riflessione di specifiche lunghezze d’onda. Le proprietà di assorbimento della luce dei pigmenti forniscono le basi per analisi di tipo qualitativo e quantitativo (Spettroscopia).
Se in possesso di uno spettrofotometro, potremo fare anche una analisi qualitativa della clorofilla, misurandone lo spettro di assorbimento.
Nelle foglie oltre alla clorofilla ci sono i carotenoidi, pertanto facendo l’estrazione dei pigmenti otterremo una soluzione di clorofilla grezza da cui dovremo allontanare i carotenoidi; questo lo faremo sfruttando la diversa affinità della clorofilla e dei carotenoidi per i solventi acetone e etere di petrolio, tra loro immiscibili. Una volta ottenuta la clorofilla in soluzione di acetone si potrà eseguire l’analisi ed ottenere lo spettro di assorbimento della clorofilla .
Curiosità:
La numerazione data ai fotosistemi (I e II) non deriva da una loro diversa importanza, né tanto meno dall’ordine secondo cui avvengono le reazioni all’interno degli organismi capaci di effettuare la fotosintesi ma ha solo una ragione storica: il fotosistema I è stato il primo ad essere scoperto. Esso, infatti, è stato caratterizzato da alcuni organismi fotosintetici incapaci di scindere la molecola dell’acqua (in quanto mancanti del fotosistema II) che attuavano una fotosintesi primitiva.
Attività n°7 – Verificare la fluorescenza della clorofilla a
Tagliare a pezzetti alcune foglie verdi e pestarle in mortaio assieme ad alcuni millilitri di alcol a 95° fino a ridurle in poltiglia.
Lasciare decantare e filtrare il liquido verde sopranatante in una provetta.
Esporre ad una fonte di luce, il liquido apparirà rosso perché, per fluorescenza, emette una lunghezza d’onda maggiore.
Attività n°7 bis – Analisi spettrofotometrica
La colorazione delle foglie è dovuta alla presenza dei pigmenti fotosintetici. Le clorofille a e b sono i pigmenti predominanti e danno la colorazione verde e tra i pigmenti accessori, mascherati dalla presenza delle clorofille, vi sono i carotenoidi pertanto , volendo ottenere lo spettro di assorbimento della clorofilla sarà necessario allontanare i carotenoidi dalla soluzione di estrazione . Questo sarà possibile sfruttando la diversa affinità della clorofilla e dei carotenoidi per i solventi acetone e etere di petrolio (immiscibili tra loro)
Si mettono alcune foglie di spinaci nel mortaio con un po’ di etere di petrolio e acetone in rapporto 1:1 e si pestano.
Si ottiene una soluzione di clorofilla grezza che viene filtrata e trasferita in una provetta; si aggiunge un po’ di soluzione di etere e acetone e si agita fortemente e poi si lascia decantare. Per diversa affinità con i solventi usati si avrà così nella parte superiore una soluzione verde contenente le clorofille che analizzeremo allo spettrofotometro e nella parte inferiore una soluzione più giallastra contenente i pigmenti (xantofille e caroteni).
Con una pipetta si preleva il liquido verde e si trasferisce in un’altra provetta, si aggiunge acetone (la soluzione non deve essere troppo concentrata) e si esegue l’analisi allo spettrofotometro (figura 10).
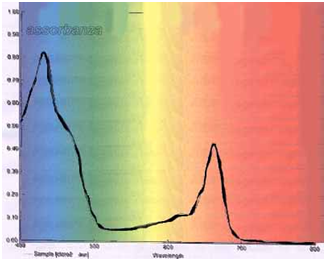
Utilizzando foglie di diverso tipo trattate con lo stesso procedimento, si possono ottenere diversi spettri che hanno in comune gli stessi picchi di assorbimento e quindi appartengono agli stessi pigmenti.
Attività 8 – Dove si trova la clorofilla?
Analisi dell’ambiente in cui avviene la fotosintesi: la foglia
Osservazione al microscopio per localizzare i cloroplasti che contengono la clorofilla.
Per questa attività si utilizzeremo Elodea (Elodea canadensis) una pianta acquatica che vive sommersa nelle acque dolci che è facilmente reperibile nei negozi che vendono acquari. Le foglie di Elodea vengono osservate al microscopio ottico, senza alcuna preparazione particolare: queste foglie sono molto sottili, costituite solitamente da uno, due strati di cellule a livello della lamina fogliare e per questo è possibile apprezzare la forma e le dimensioni delle singole cellule ed osservare all’interno i cloroplasti che appaiono come piccoli e numerosi corpiccioli verdi, di forma pressocché sferica o ellissoidale. Se si usa Elodea, è anche possibile osservare le correnti citoplasmatiche, sotto forma di un movimento di ciclosi dei cloroplasti, soprattutto nelle cellule in prossimità della nervatura. Tali movimenti sono indotti dal calore prodotto dalla luce del microscopio diretta sul campione

Attività n°9 – Misura della velocità della fotosintesi
Si avvia una discussione, e si arriva a stabilire che si può misurare la velocità del processo attraverso la misura della quantità di prodotto che si forma; si concentra l’attenzione sullo sviluppo di ossigeno e si pensa ad un semplice dispositivo per misurare l’ossigeno che si sviluppa in un intervallo di tempo definito .
Le variabili che vengono individuate sono: intensità luminosa ,la lunghezza d’onda della luce , la temperatura , la disponibilità di anidride carbonica e di acqua.
Verrà studiato l’effetto di un fattore alla volta mantenendo rigorosamente costanti le altre variabili, registrando i risultati ottenuti in termini di quantità di ossigeno prodotto.
Dovendo misurare il volume di ossigeno che si sviluppa si utilizzerà una siringa da 20ml dove si introducono 2-3 pezzetti di Elodea ( lunghi 5 cm) ottenuti tagliando con una lametta le estremità dei campioni praticando il taglio tra due nodi ( punti a livello dei quali le foglie si attaccano al fusto) .
Tolto lo stantuffo si posizionano i rametti di elodea con le estremità rivolte tagliate rivolte verso l’alto. Il cilindro della siringa si fissa con un morsetto per mantenerlo dritto e si inserisce un capillare lungo 30 cm al posto dell’ago. Mettendo un dito sull’estremità aperta del tubo capillare si riempie tubo e siringa fino all’orlo con l’acqua; facendo attenzione che nella siringa non entri aria, si rimette lo stantuffo e togliendo il dito dal fondo del capillare si applica una leggera pressione fino a che lo stantuffo non raggiunge la tacca 20ml. Si solleva quindi fino a portare l’acqua quasi in cima al capillare e si segna il livello del menisco .
Il dispositivo sperimentale è pronto per l’uso.

Sistemato in un luogo ben illuminato, dopo 10’ nella siringa si sarà raccolto del gas . Esso spingerà l’acqua contenuta nel capillare, spostando il menisco verso il basso (figura 12). Si misura la distanza tra il livello originale del menisco e quello registrato dopo 10’. Si faranno il maggior numero possibile di letture, a intervalli di 10’ l’una dall’altra.
Come si può variare l’intensità della luce?
Ciascun gruppo pensa ad un modo per variare l’intensità della luce a cui esporre la pianta .
I dati registrati serviranno per costruire un grafico per dimostrare l’effetto della variazione dell’intensità luminosa sulla velocità della fotosintesi .
Il dispositivo può essere usato in molti modi, per esempio si possono usare dei filtri rossi e verdi per vedere se la velocità della fotosintesi cambia in funzione della lunghezza d’onda della luce oppure si può modificare la quantità di anidride carbonica disponibile aggiungendo diverse quantità di soluzione di bicarbonato di sodio all’acqua contenuta nella siringa.
Perché è necessario ripetere diverse volte ogni esperimento?
Perché il risultato dell’esperimento può essere alterato nel caso in cui rimanga un po’ di aria intrappolata sotto lo stantuffo della siringa, nel corso dell’allestimento del dispositivo strumentale?
Quando si fa variare l’intensità luminosa quali altri fattori ambientali probabilmente cambiano?
Qual è la relazione tra velocità della produzione di ossigeno e intensità della luce a cui la pianta viene esposta?
Se i tuoi risultati differiscono da quelli dei tuoi compagni come spieghi le differenze?
Quali difficoltà hai incontrato nell’allestire l’esperimento?
Attività 9 bis – Misura indiretta della velocità della fotosintesi attraverso il galleggiamento delle foglie
Questa semplice attività ci consentirà di vedere gli effetti della fotosintesi su alcuni pezzetti circolari di foglia, che chiameremo dischetti.
Di solito nell’acqua le foglie galleggiano. Questo accade per la presenza di gas nel mesofillo fogliare, che è formato da cellule tondeggianti disposte in modo irregolare, con ampi spazi intercellulari. Se questi spazi vengono riempiti con una soluzione, la densità complessiva aumenta e la foglia affonda.
Durante l’attività, si infiltrano i dischetti con una soluzione contenente una piccola quantità di bicarbonato di sodio (NaHCO3) e detergente: questo ne aumenterà la densità, facendoli affondare (l’aggiunta del detergente è necessaria per ridurre la tensione superficiale della soluzione e permettere alle foglie di “affondare”).
Poco dopo, però, si potrà osservare che ricominceranno a galleggiare. Questo perché gli ioni bicarbonato servono come fonte alternativa di biossido di carbonio per la fotosintesi, che procedendo rilascerà ossigeno, il quale a sua volta, accumulandosi all’interno della foglia, ne modificherà la galleggiabilità.
La velocità con cui i dischi risaliranno in superficie ti darà una misura indiretta della velocità con cui avviene la fotosintesi.
Prendere una siringa, rimuoverei lo stantuffo e inserire all’interno i dischetti di foglia.
Rimettere lo stantuffo e abbassarlo finché resta solo una piccola quantità d’aria (<10%), facendo attenzione a non schiacciare i dischetti. aspirare un piccolo volume di soluzione di bicarbonato nella siringa e agitarla delicatamente per mettere in sospensione i dischetti di foglia nella soluzione. Chiudere con un dito l’apertura della siringa e tirare lo stantuffo per creare un vuoto all’interno. Mantenere questo vuoto per circa 10 secondi continuando ad agitare la siringa.
Trascorso questo tempo, lasciare andare lo stantuffo: la soluzione di bicarbonato si sarà infiltrata negli spazi aerei nella foglia e causerà l’affondamento dei dischetti, che si ammasseranno sullo stantuffo (se teniamo la siringa rivolta verso l’alto).
Probabilmente sarà necessario ripetere quest’ultima procedura due o tre volte . Se i dischetti non affondano, è probabile che nella soluzione non ci sia abbastanza sapone: aggiungine altro e ripetere tutto.
Versare la soluzione con il bicarbonato di sodio in un bicchiere di plastica trasparente fino a un livello di circa tre cm e mettere i dischetti nella soluzione. Per avere un gruppo di controllo, invece, mettere i dischetti di foglia in una soluzione di sola acqua e sapone senza bicarbonato.
Porre entrambi i bicchieri sotto una fonte di luce (per esempio una lampada da tavolo) e far partire il cronometro. Alla fine di ogni minuto, registrare il numero di dischetti che galleggiano. Se necessario, mescolare la soluzione per rimuovere dalle pareti del bicchiere i dischetti che possono esservi rimasti adesi. Fermarsi solo quando tutti i dischetti galleggeranno.
Ripetere la procedura, ma questa volta, coprire il bicchiere in modo che i dischetti rimangano al buio. ogni minuto rimuovi la copertura e conta quanti dischetti galleggiano.
Realizzare un grafico mettendo sull’asse delle ascisse i “minuti trascorsi” e sull’asse delle ordinate il numero dei “dischetti galleggianti”. Mettere nel grafico i dati che sono stati ottenuto in entrambe le prove evidenziandoli in modo differente e con un’adeguata legenda. Osservare attentamente l’andamento dei due grafici ottenuti e formulare un’ipotesi che ne spieghi l’andamento.
Note e storia
Storia
Esaminare gli esperimenti del passato aiuta i ragazzi ad acquisire una prospettiva storica e a capire come i progressi della scienza hanno influenzato la nostra comprensione del mondo.
Tra gli esperimenti che rappresentano tappe fondamentali nella storia della scoperta della fotosintesi : esperimento di van Helmont ( si collega all’ attività 2), esperimento di Priestley, ( dimostra che le piante durante la fotosintesi producono ossigeno…potrebbe precedere l’attività 9), e l’esperimento di Engelmann (quali lunghezze d’onda “azionano la fotosintesi”).
Approfondimento
Copiare le piante : la fotosintesi artificiale.Il Massachusetts Institute of Technology (MIT), uno dei più importanti centri di ricerca al mondo, sembra avere vinto questa sfida. Al MIT il Prof. Daniel Nocera, che sta da tempo studiando come realizzare una foglia artificiale, ha inventato un dispositivo capace di trasformare ovunque e con poca spesa l’energia solare in elettricità. La foglia di Nocera è minuscola, appena più grande di una carta da gioco, ed è realizzata con materiali poco costosi. Il prototipo realizzato nei laboratori del MIT, a differenza dei suoi precedenti, è stabile e affidabile e ha funzionato ininterrottamente per 45 ore.
Note
L’esperimento 93-Scienze “Fotosintesi e scambi gassosi” prevede attività che potrebbero essere collegate a questo percorso.
L’esperimento 97-Scienze “Ricerca dell’amido in una foglia” si può ritenere equivalente alle attività n°3 e n°4 previste nel percorso.
L’esperimento 92-Scienze “Pigmenti fotosintetici” è equivalente all’attività del percorso n°5: uso della tecnica della cromatografia su carta per la separazione dei pigmenti fotosintetici.
Bibliografia
- Nuffield Biologia Zanichelli;
- H. Curtis Biologia Zanichelli;
- Esperimento di Engelmann;
- Foglia-Wikipedia.
Autori
Marchetti Gloria