L’esperienza consiste nell’estrazione dei cloroplasti dalle foglie di spinacio, nell’isolamento dei tilacoidi e nella successiva osservazione/misurazione della loro capacità di catalizzare la reazione di Hill (fotoriduzione di un accettore di elettroni, il diclofofenoloindofenolo o il ferricianuro, a spese dell’ossidazione dell’acqua). L’esecuzione dell’esperienza consente di comprendere il funzionamento della catena di trasporto elettronico fotosintetica e il ruolo svolto dalla radiazione luminosa e di individuare il donatore di elettroni del processo.

Scheda esperimento
| Classi | 5° anno |
| Tipologia | Attrezzato |
| Durata | 2 h |
 |  |  |  |
Scheda sintetica delle attività
Il laboratorio proposto si articola nelle seguenti fasi:
1) estrazione e osservazione dei cloroplasti e isolamento dei tilacoidi;
2) osservazione qualitativa della reazione di Hill mediante il cambiamento di colore (da blu a incolore), causato dalla riduzione indotta dalla luce, del diclorofenoloindofenolo (DCPIP);
3) analisi quantitativa della reazione di Hill , seguendo tramite spettrofotometria la variazione di assorbanza legata alla fotoriduzione del ferricianuro (composto giallo-arancio, con massimo di assorbimento a 420nm, incolore in forma ridotta).
Risorse necessarie
- Bilancia;
- mortaio e pestello in porcellana;
- colino e calze di nylon;
- falcon da 50 e 15 mL;
- pipette Pasteur;
- centrifuga (possibilmente refrigerata);
- microscopio ottico;
- vetrini porta- e coprioggetto;
- micropipette (p1000 e p100);
- spettrofotometro;
- foglie di spinaci fresche (o di altra specie con foglia poco legnosa);
- tampone ISO (isotonico): 0,242 g Tris; 7,2868 g mannitolo; 0,1168 g NaCl; 0,061 g MgCl2; portare a 100 mL con acqua distillata e a pH 7,8 con HCl;
- tampone IPO (ipotonico): 0,242 g Tris; 0,1168 g NaCl; 0,061 g MgCl2; portare a 100 mL con acqua distillata e portare a pH 7,8 con HCl.
- dicrorofenoloindofenolo (DCPIP): 110 µM (3,2mg in 100 mL di acqua distillata)
- ascorbato in polvere;
- ferricianuro di potassio
\(K_3Fe(CN)_6\) :1 mM (0,0329 g in 100 mL di acqua distillata).
Prerequisiti necessari
- Conoscenza della struttura della foglia e dei cloroplasti; conoscenza degli effetti osmotici sulle cellule;
- conoscenza del processo fotosintetico, dei fotosistemi e della fase luce-dipendente;
- conoscenza delle reazioni di ossidoriduzione e dei potenziali redox;
- conoscenza di principi di spettrofotometria e della legge di Lambert-Beer;
- conoscenza di principi di cinetica chimica.
Obiettivi di apprendimento
- Saper utilizzare tecniche spettrofotometriche nello studio di reazioni di ossidoriduzione;
- Saper misurare la velocità di trasporto elettronico indotta dalla luce in vescicole tilacoidali;
- Comprendere la fase luce-dipendente della fotosintesi;
- Comprendere il suo ruolo biologico.
Dotazioni di sicurezza
Rispetto della normativa sicurezza dei lavoratori (Testo unico N. 81). Utilizzo di dispositivi di protezione individuale (camice, guanti, occhiali protettivi). I reattivi utilizzati non richiedono particolari precauzioni d’uso; entrambi i reattivi redox utilizzati sono sostanze o miscele non pericolose secondo la regolamentazione (CE) N. 1272/2008 (v. schede di sicurezza allegate).
Svolgimento
Introduzione
La fotosintesi può essere definita come una reazione di ossido-riduzione in cui l’anidride carbonica viene ridotta a sostanza organicamente l’acqua è ossidata ad ossigeno. L’energia necessaria per questa reazione viene fornita dalla luce. Questo processo redox avviene in più fasi e coinvolge inizialmente una sequenza di fotosistemi e di trasportatori di elettroni situati nelle membrane tilacoidali, la produzione luce-dipendente di ATP e NADPH ed il loro utilizzo nello stroma per la riduzione di anidride carbonica (ciclo di Calvin-Benson).
L’esecuzione dell’esperienza consente di comprendere il funzionamento della catena di trasporto elettronico fotosintetica e il ruolo svolto dalla radiazione luminosa e di individuare il donatore di elettroni del processo.
Preparazione del campione
- Lavare le foglie di spinaci sotto acqua corrente e asciugarle per quanto sia possibile
- Pesare 5 g di foglie scartando le parti più legnose (nervatura centrale e gambo).
- Porre le foglie nel mortaio (preraffreddato e appoggiato su ghiaccio) e pestarle per 5 minuti con 15 mL di tampone ISO, omogeneizzando bene.
- Filtrare (calze nylon) con un colino e recuperare in una Falcon da 50 mL il succo di spinacio (tenere in ghiaccio).
- Trasferire 5 ml del succo di foglie ottenuto in una provetta da 15 ml
- Centrifugare per 10 min a 1500 rpm (possibilmente in centrifuga refrigerata); questo passaggio permette di eliminare cellule ancora intere e le pareti cellulari.
- Prendere con molta attenzione la provetta dalla centrifuga senza risospendere il precipitato, prelevare il surnatante e trasferirlo in una nuova Falcon (da 15 ml). Il surnatante può essere osservato al microscopio ottico (400x) per visualizzare i cloroplasti isolati.
- Centrifugare per 10 min a 3500 rpm (in centrifuga refrigerata possibilmente); questo passaggio ha lo scopo di separare i cloroplasti dal contenuto citoplasmatico.
- Eliminare il surnatante con attenzione con una pipetta Pasteur.
- Risospendere delicatamente il pellet in 0,5 ml di Tampone IPO (si ottiene la rottura della membrana esterna dei cloroplasti).
- Aggiungere, subito dopo aver risospeso, 0,5 ml di Tampone ISO. I cloroplasti così ottenuti hanno perso lo stroma, ma mantengono i tilacoidi a livello della cui membrana avviene il trasporto fotosintetico di elettroni.
- Conservare la provetta al buio avvolta nella stagnola in frigorifero per almeno 20 min.
La sospensione di tilacoidi verrà utilizzata per visualizzare/misurare la Reazione di Hill.
Osservazione qualitativa della reazione di Hill con DCPIP
Preparare delle provette da 15 ml contenenti le varie miscele di reazione come nello schema di tabella 1 (buio= avvolgere completamente la provetta in stagnola).

Procedere come descritto:
- condurre l’irraggiamento per 10 minuti con una lampada fluorescente (100 watt) ad una distanza di 5 cm.
- Porre i campioni di controllo (provette N. 1, 3, 4 e 5) alla stessa distanza dalla lampada rispetto al campione contenente DCPIP + tilacoidi (provetta N. 2) dove avviene a la reazione di Hill.
- Aggiungere l’ascorbato nella provetta N. 5 alla fine dell’irraggiamento.
- Osservare in quale provette è avvenuta la decolorazione (riduzione del DCPIP).

Osservazione quantitativa della reazione di Hill con Ferricianuro mediante l’uso dello spettrofotometro.
Preparare 2 cuvette marcate con Bi (=Bianco) e con C(=Campione), come indicato in tabella 2.

Procedere come descritto:
- Misurare il valore di assorbanza del campione a 420 nm dopo aver calibrato coi bianco (Tempo 0)
- Porre subito le cuvette sotto una lampada al neon a circa 3 cm di distanza. L’ esposizione alla luce dà il via alla riduzione del ferricianuro, che viene seguita leggendo l’assorbanza dei campioni allo spettrofotometro a intervalli di 2 min per 4 volte. Ogni volta calibrare lo strumento con il bianco (Bi) e leggere l’assorbanza di C: in teoria ad ogni lettura i valori di assorbanza dovrebbero calare perché i cloroplasti, grazie alla luce, riducono il ferricianuroche da colorato diventa trasparente.
- Parallelamente effettuare le 4 letture anche per un campione mantenuto al buio (basta lasciarle la cuvette nell’alloggiamento all’interno dello spettrofotometro).
- Ripetere la misura 4 volte e annotare i valori di assorbanza, come indicato in tabella 3.
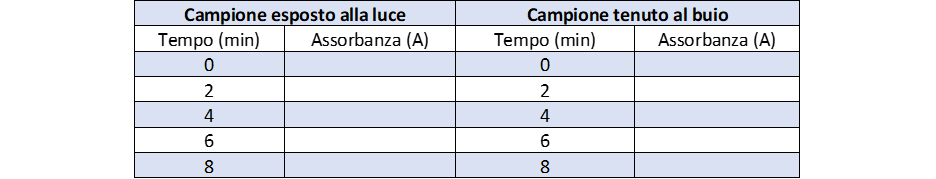
Dai dati sperimentali si può ricavare un unico risultato quantitativo che rappresenti un indice della velocità della catena di trasporto degli elettroni. Se si pongono in un grafico i tempi (min) sull’asse delle ascisse e i valori dell’assorbanza su quello delle ordinate, si dovrebbe ottenere una retta con andamento decrescente. Calcolare la retta di tendenza e il valore del coefficiente di correlazione lineare (R2) per avere un’idea della accuratezza della procedura (eventualmente eliminare gli ultimi valori ottenuti se tendenti troppo ad una funzione logaritmica).
Il numero di moli di ferricianuro di potassio ridotte per secondo per litro di soluzione (M) è dato dalla seguente relazione:
\[\textbf{M} = \frac{C_1 – C_2}{120} [mol \cdot L^{-1} \cdot s^{-1}]\]
dove
\(C_1 = \frac{A(t=2 min)}{\epsilon \cdot d} \hspace{4 cm} C_2 = \frac{A(t=4 min)}{\epsilon \cdot d}\)
con \(\epsilon = 1040\ M^{-1} \cdot cm^{-1}\).
Note e storia
La reazione di Hill
Nel 1937 il biochimico inglese Robert Hill (Leamington, 1899 –Cambridge,1991)scoprì che un omogenato di foglia è in grado di emettere ossigeno se viene illuminato in presenza di un sale ferrico come l’ossalato.
Nel 1954, quando per la prima volta si riuscì ad ottenere un preparato di cloroplasti intatti e funzionali, venne dimostrato come il sistema in grado di svolgere ossigeno fosse localizzato nei tilacoidi dei cloroplasti
Il sistema tilacoidale dei cloroplasti è dunque in grado di catalizzare la cosiddetta reazione di Hill, definita come la fotoriduzione di un accettore di elettroni a spese dell’acqua (che libera il prodotto dell’ossidazione, l’ossigeno molecolare), in assenza di riduzione della \(CO_2\).
In presenza di tilacoidi e luce:
\[4Fe^{3+} + 2H_2O \longrightarrow 4Fe^{2+} + O_2 + 4H^+\]
La scoperta di Hill ha quindi determinato che la reazione fotosintetica necessita di un accettore intermedio di elettroni, che oggi sappiamo essere il NADP+ che viene ridotto nella fase dipendente dalla luce a NADPH, il quale a sua volta serve come agente riducente per la fissazione del carbonio.
La reazione di Hill contribuì inoltre ad ipotizzare che l’ossigeno rilasciato dalla fotosintesi derivi dall’acqua e non dalla \(CO_2\) (come precedentemente ipotizzato), fatto successivamente confermato tramite l’utilizzo di isotopi radioattivi (\(^{18}O\)).
Il DCPIP
Il 2,6 –diclorofenoloindofenolo viene utilizzato come indicatore nelle reazioni di ossidoriduzione (reazione di Hill, dosaggio della vitamina C,…) per la sua caratteristica di essere blu nella condizione ossidata ma incolore quando è ridotto:
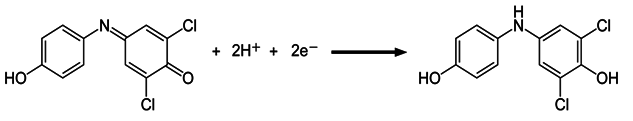
DCPIP OSSIDATO, COLORE BLU DCPIP RIDOTTO, INCOLORE
La forma ossidata presenta un picco di assorbimento alla lunghezza d’onda di 575 nm; la reazione di Hill può quindi essere seguita anche colorimetricamente misurando la perdita di colore blu man mano che il DCPIP viene ridotto.
Il ferricianuro
Il ferricianuro di potassio (o potassio esacianoferrato (III)) a temperatura ambiente si presenta come un solido rosso scuro inodore. In soluzione acquosa presenta un colore giallino e un coefficiente di estinzione molare pari a 1,02 \(mM^{−1} \cdot cm^{−1}\) a lunghezza d’onda di 420 nm. La forma ridotta è il ferrocianuro di potassio, incolore:
\[4Fe(CN)_6^{3-} + 2H_2O \longrightarrow 4Fe(CN)_6^{4-} + 4H^+ + O_2\]
ferricianuro, giallo \(\longrightarrow\) ferrocianuro, incolore
Bibliografia
- Fase luce dipendente-Wikipedia;
- Fotosistema-Wikipedia;
- Dichlorophenolindophenol-Wikipedia;
- Hill reaction-Wikipedia;
- DCMU-Wikipedia.
Autori
Fumich Simonetta
Angelini Riccardo