Riassunto / Abstract
L’esperienza propone lo svolgimento di una reazione chimica finalizzata al riconoscimento delle proteine. Il campione contenente le proteine viene fatto reagire con il Biureto, un reattivo contenente rame (II) e tartrato di sodio e potassio. Le proteine in ambiente basico e in presenza di ioni
Il test del Biureto è positivo per proteine e polipeptidi, mentre è negativo per dipeptidi ed amminoacidi liberi. L’intensità della colorazione viola è proporzionale alla concentrazione dicomponente proteica o polipeptidica presente nel campione.
Scheda sintetica delle attività
1. TEST SU RIFERIMENTI STANDARD
1.1. Preparazione dei reattivi;
1.2 esecuzione del test per i riferimenti di saggio positivo e saggio negativo.
2. INDAGINE: QUALI ALIMENTI CONTENGONO PROTEINE?
2.1 Preparazione dei campioni (solidi e liquidi);
2.2 ricerca di proteine nei campioni.
Risorse necessarie
● Provette;
● contagocce;
● siringhe;
● mortaio con pestello;
● bilancia;
● 2 becher (o bicchieri);
● acqua distillata;
● idrossido di sodio (soda caustica);
● solfato rameico pentaidrato;
● tartrato di sodio e potassio (sale di Seignette, reperibile in farmacia).
Prerequisiti necessari
Formazione di ioni complessi;
struttura dei gruppi funzionali ammino e carbossile.
Obiettivi di apprendimento
- Progettare semplici indagini scientifiche;
- acquisire la capacità di riconoscere la presenza di proteine in un campione;
- correlare la reattività di proteine e polipeptidi alla presenza di specifici gruppi funzionali.
Dotazioni di sicurezza
- Guanti;
- occhiali di protezione;
- camice.
Svolgimento
1. TEST SU RIFERIMENTI STANDARD
1.1 Preparazione del reattivo
A. Si preparano 300 ml di
B. si pesano separatamente 1,5 g di \(CuSO_4\) e 6 g di Sodio e Potassio Tartrato;
C. i due sali vengono disciolti nella soluzione di \(NaOH\) al 10% (m/V);
D. si porta a volume di 1L con acqua;
E. conservare la soluzione al riparo della luce (contenitore scuro o avvolto in alluminio).
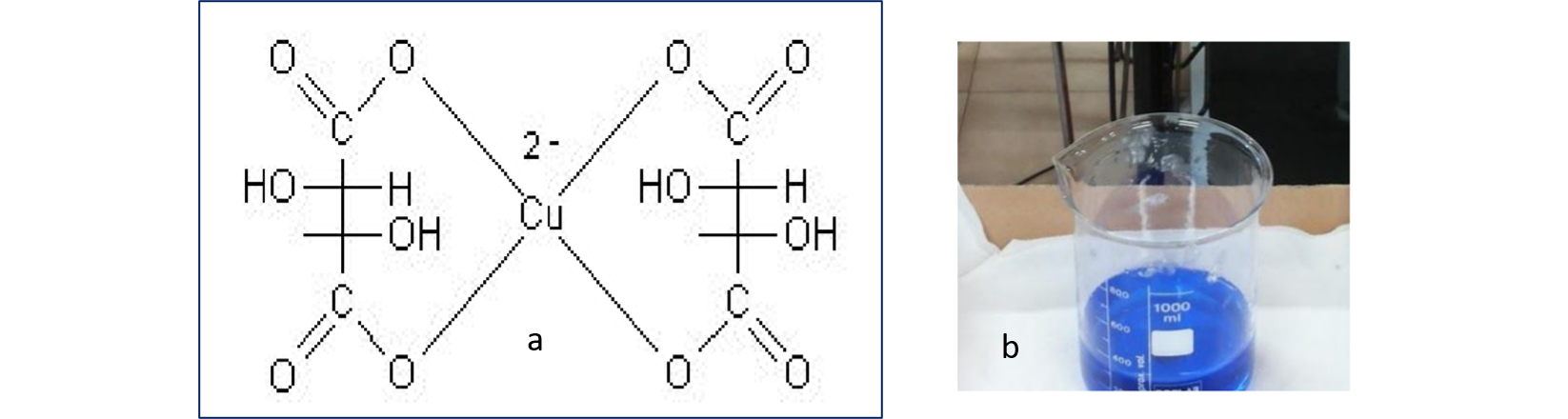
Il reattivo è così preparato in quanto il rame in soluzione,\(Cu^{2+}\) in ambiente basico, dovrebbe precipitare come idrossido, \(Cu(OH)_2\). La presenza del tartrato mantiene il rame in soluzione attraverso la formazione di un complesso in cui lo ione rameico centrale viene tetracoordinato dagli atomi di ossigeno delle funzioni carbossiliche (figura 1a). Il complesso impartisce alla soluzione una intensa colorazione blu (figura 1b).
1.2 Preparazione del riferimento positivo con albume d’uovo
- Rompere l’uovo ed estrarne solo l’albume;
- prelevare mediante una siringa circa 1 ml di albume e versarlo in un bicchierino di plastica;
- aggiungere 5 ml di acqua all’albume;
- versare la soluzione albume-acqua in un provettone (contenitore di vetro);
- inserire nella provetta, mediante l’uso di una siringa, 2 ml di reattivo di Biureto;
- miscelare energicamente;
- osservare la formazione di un cambiamento di colore della soluzione dal blu al viola, dovuta al fatto che il rame viene complessato dai gruppi funzionali della proteina (figura 2).

La colorazione blu-viola in presenza di proteine è dovuta al fatto che gli ioni rameici del reattivo formano un complesso di coordinazione con gruppi NH (da due a quattro) appartenenti ad altrettanti legami peptidici. Per questo, il saggio sarebbe negativo con amminoacidi liberi e dipeptidi, mentre è positivo per tripeptidi, polipeptidi e molecole proteiche, in cui si ha un sufficiente numero di gruppi \(-CONH^-\) (ma anche \(CH_2NH_2\) e \(CSNH\)).
1.3 Preparazione del riferimento negativo con acqua distillata
Il riferimento negativo si può ovviamente considerare quello che si ottiene su acqua distillata, aggiungendovi due ml di reattivo: la colorazione intensa del reattivo mantiene la sua caratteristica tonalità azzurra.
2. INDAGINE: QUALI ALIMENTI CONTENGONO PROTEINE?
L’insegnante propone agli studenti un’attività di indagine basata sulla metodica sperimentale precedentemente messa a punto per testare la presenza o l’assenza di componente proteica in vari tipi di alimenti.
2.1 Preparazione dei campioni
sostanze liquide
- Prelevare mediante una siringa circa 1 ml di del campione e versarlo in un bicchierino di plastica;
- aggiungere 5 ml di acqua al campione;
- versare il campione in un provettone (contenitore di vetro).
sostanze solide
- Ogni campione solido viene tagliato in parti piccolissime;
- i frammenti devono essere pestati in un mortaio;
- la poltiglia ottenuta è diluita in 5 ml di acqua;
- prelevare mediante una siringa circa 1 ml di del campione e versarlo in un bicchierino di plastica;
- aggiungere 5 ml di acqua al campione;
- versare il campione in un provettone.
2.2 Ricerca delle proteine nei campioni
- Introdurre nella provetta di ciascun campione 2 ml di reattivo di biureto e miscelare energicamente;
- osservare la formazione di un eventuale cambiamento di colore dal blu al viola (figura 3).

Note e storia
Si può eseguire una versione semplificata del test preparando separatamente le due componenti del reattivo (solfato rameico ed idrossido di sodio) da mescolare al momento direttamente nella provetta che contiene il campione da analizzare:
- aggiungere al campione prima 2 ml di \(NaOH\) al 10% (m/V) e subito dopo qualche goccia di soluzione di solfato rameico al 3,5% (m/V) (eventualmente anche in assenza di tartrato)
- mescolare energicamente ed attendere l’eventuale variazione di colore
Autori
Storti Roberta
Specifiche esperimentoMateria Chimica Classi a cui è rivolto 5° anno Tipologia di laboratorio Strumentazione semplice Reperibilità del materiale Negozi specializzati, siti web Materiale specifico Vetreria da laboratorio, mortaio con pestello, bilancia, acqua distillata, idrossido di sodio, solfato rameico pentaidrato, tartrato di sodio e potassio (sale di Seignette) Durata esperimento in classe 2 h Capacità di bricolage/assemblaggio No Necessità lavorazioni meccaniche/elettroniche No Necessità PC per acqusizione/analisi dati No Necessità di uno smartphone No Parole chiave Chimica Molecole biologiche Proteine Formazione di complessi |