Riassunto / Abstract
Questa esperienza si propone di realizzare una duplice serie di soluzioni a concentrazione nota, in modo da poter effettuare un confronto visivo attraverso le differenze cromatiche che un soluto, come il solfato di rame idrato, dà quando è presente in soluzione acquosa e dedurre le relazione fra rapporto soluto/solvente e concentrazione.
Scheda sintetica delle attività
Questo tipo di attività può essere effettuata in laboratorio singolarmente o, preferibilmente, in gruppo.
Si tratta di preparare due serie di soluzioni così costituite:
- prima serie: uguale concentrazione e volumi diversi;
- seconda serie: diversa concentrazione e volumi uguali
La concentrazione potrà essere espressa in g/L o in molarità (M).
Ad ogni gruppo sarà affidata la realizzazione di due soluzioni, una della prima serie e una della seconda serie, dando solo le indicazioni che riguardano la massa e il volume per ognuna delle due soluzioni, senza specificarne la concentrazione.
Come soluto è bene utilizzare un sale solubile e colorato come il
I dati raccolti vengono commentati assieme.
Risorse necessarie
La strumentazione in elenco è tutto ciò che serve per 6 gruppi:
- acqua distillata in spruzzetta;
- \(CuSO_4 \cdot 5H_2O\) (quanto basta)
- 6 matracci da: 25 ml, 50 ml, 100 ml, 250 ml, 500 ml, 1000 ml;
- 6 matracci tutti da 100 ml;
- 6 becher da 50 ml;
- 6 spatole;
- 6 imbuti di vetro;
- 6 bacchette di vetro;
- 6 pipette contagocce;
- bilancia tecnica (s= 0,01 g).
Prerequisiti necessari
- Concetto di soluzione;
- mole e massa molare (classe seconda);
- saper utilizzare le formule: g = moli x MM e moli = g / MM (classe seconda);
- conoscenza dell’utilizzo del materiale e della bilancia tecnica.
Obiettivi di apprendimento
- Comprensione del concetto di concentrazione espressa in g/litro (o in moli/litro);
- comprensione del concetto di concentrazione attraverso la preparazione di soluzioni colorate caratterizzate da diversa o uguale intensità cromatica;
- capacità di saper preparare correttamente una soluzione a concentrazione nota con utilizzo del matraccio.
Dotazioni di sicurezza
Uso di camice e guanti.
Verificare la scheda di sicurezza dei reagenti utilizzati (per es. su http://host.uniroma3.it/centri/cisdic/sicurezza.htm alla voce rame solfato)
Svolgimento
Realizzazione delle soluzioni
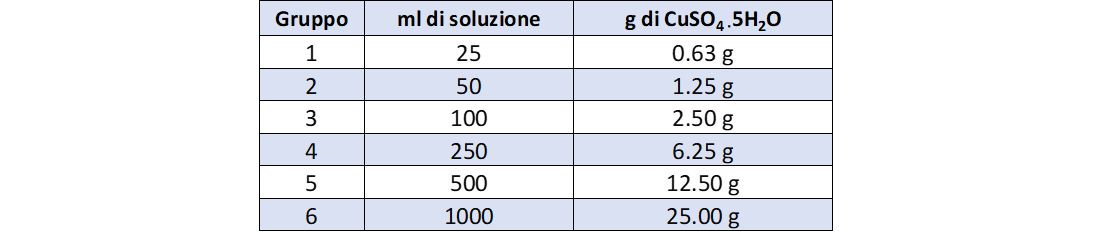
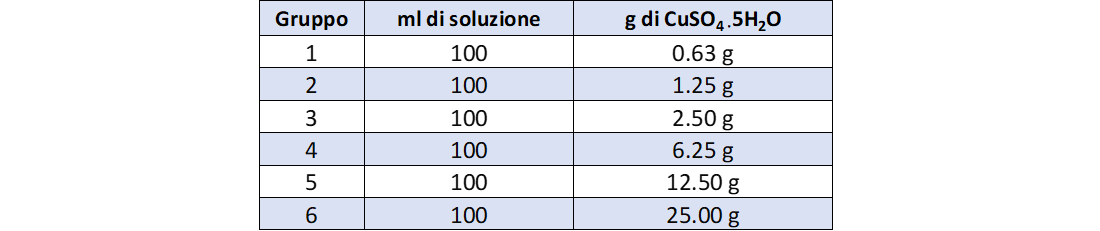
Sono qui riportati i dati per sei gruppi di lavoro.
Ciascun gruppo dovrà inizialmente annotare le seguenti informazioni per poter effettuare la prova:
- massa del soluto in g;
- volume della soluzione.
Ogni gruppo preparerà una soluzione della prima serie e una soluzione della seconda serie
Operazioni da eseguire per la preparazione di una soluzione a concentrazione nota:
- pesare il soluto nel becher da 50 ml, alla bilancia tecnica;
- trasferire (utilizzando l’imbuto) il soluto nel matraccio della capacità corrispondente al volume di soluzione;
- eseguire dei lavaggi, con acqua distillata, del becher usato, in modo da recuperare completamente il soluto, travasandoli di volta in volta nel matraccio;
- aggiungere poco alla volta acqua distillata, continuando a miscelare la soluzione eseguendo dei movimenti rotatori del contenitore;
- utilizzando il contagocce portare a volume, facendo raggiungere il livello della soluzione sino alla tacca indicata sul matraccio;
- verificare posizione menisco (figura 1)
- tappare il matraccio ed omogeneizzare la soluzione capovolgendo il matraccio più volte.
Discussione
Con questo tipo di esperienza si possono evidenziare e discutere in corso d’opera:
- il processo di dissoluzione;
- la corretta lettura del menisco
Lettura ed interpretazione dei dati
La tabella 3 riporta i dati di concentrazione della prima serie di soluzioni.
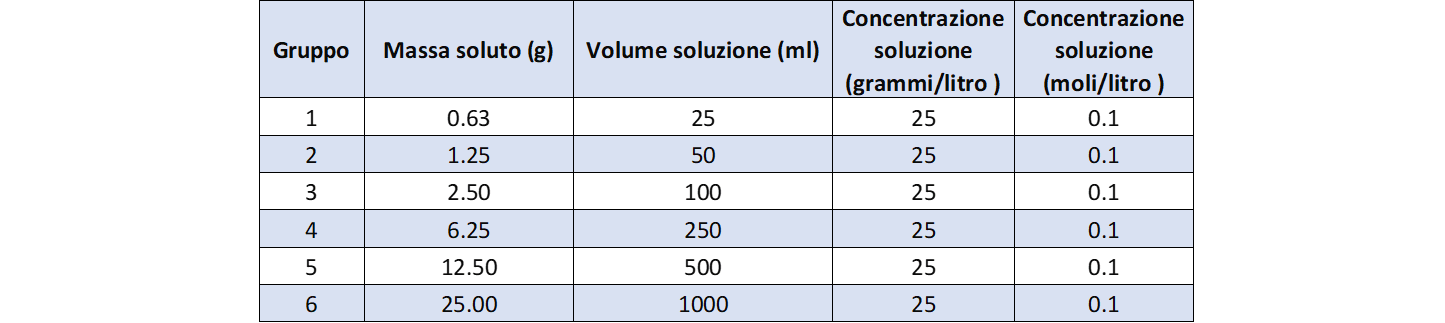
La figura 2 mostra come esse visivamente appaiono egualmente colorate.
La tabella 4 riporta i dati di concentrazione della seconda serie di soluzioni.
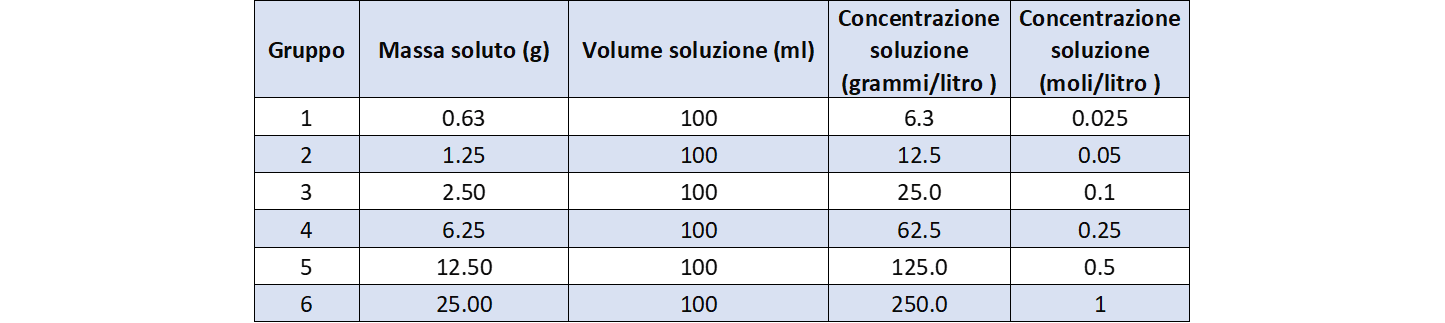
La figura 3 mostra come esse visivamente appaiono colorate diversamente.
Al termine di questa esperienza il confronto tra le due serie di soluzioni preparate (ed etichettate) dai vari gruppi di studenti darà modo loro di notare che:
- quelle cromaticamente uguali risultano avere lo stesso rapporto g/L ossia la stessa concentrazione;
- quelle cromaticamente diverse risultano avere diverso rapporto g/L ossia diversa concentrazione;
- inoltre, se qualche gruppo, come spesso succede, sbaglia nella tecnica di preparazione della soluzione, questo errore verrà immediatamente visualizzato da tutti;
- infine, facendo travasare parte di una soluzione da un matraccio più grande ad uno più piccolo, tutti vedranno che la colorazione non è cambiata, concludendo che una soluzione può essere usata parzialmente senza che per questo il suo titolo cambi.
La modalità di realizzazione di questa esperienza dà modo agli studenti di riflettere sul fatto che diverse quantità di soluto disciolte in diversi volumi possono portare a concentrazioni uguali (se il loro rapporto si mantiene costante) o differenti (se i rapporti sono diversi) permettendogli di riflettere sul concetto di concentrazione e le sue applicazioni.
Bibliografia
- http://online.scuola.zanichelli.it/chimicafacile;
- http://it.wikipedia.org/wiki/soluzione_(chimica)#concentrazione.
Autori
Campacci Silvia
Specifiche esperimentoMateria Chimica Classi a cui è rivolto 1° biennio Tipologia di laboratorio Strumentazione semplice Reperibilità del materiale Negozi specializzati, siti web Materiale specifico Vetreria da laboratorio, solfato di rame pentaidrato, matracci di varie dimensioni, bilancia Durata esperimento in classe 2 h Capacità di bricolage/assemblaggio No Necessità lavorazioni meccaniche/elettroniche No Necessità PC per acqusizione/analisi dati No Necessità di uno smartphone No Parole chiave Chimica Miscugli omogenei ed eterogenei Soluzioni Concentrazione |