Riassunto / Abstract
Lo studio dei modelli atomici è l’occasione per una riflessione storica, epistemologica e filosofica sulle idee che si sono avvicendate nel corso del tempo su questo argomento e sul metodo scientifico; in particolare sulla costruzione e sull’uso di modelli esplicativi e sui metodi di indagine della realtà. Ne emerge un percorso interdisciplinare, di cui l’esperimento 21-Scienze “La materia continua o discontinua” costituisce la prima parte, in cui lo studente apprende, sperimentando, che la scienza è una costruzione “sociale” di saperi.
Filosofia: Introduzione al concetto di paradigma e di rivoluzione scientifica nella prospettiva di Thomas Khun (allegato: “percorso filosofico”)
Chimica:
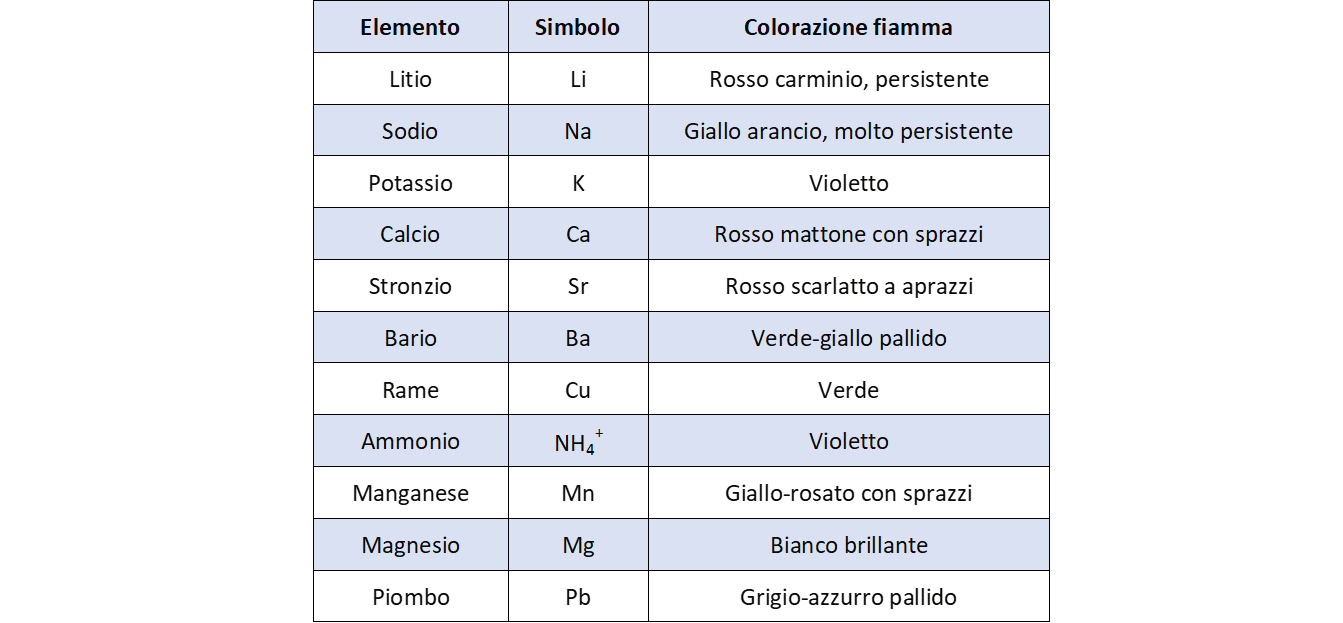
- I saggi alla fiamma
- Energie di ionizzazione: modello atomico a livelli e orbitali
L’interdisciplinarità con Fisica è solo accennata perché questa disciplina affronta questi argomenti durante il quinto anno. E’ comunque possibile che, durante l’ultimo anno, il percorso venga ripreso tra fisica e filosofia e venga approfondito il modello epistemologico di Kuhn che qui è solo accennato.
Scheda sintetica delle attività
Filosofia
- Introduzione al concetto di paradigma e di rivoluzione scientifica nella prospettiva di Thomas Khun (STEP 5 dell’allegato ” Il percorso filosofico”);
- conclusioni: I tratti essenziali della visione atomistica del mondo; l’atomismo nella storia della scienza (STEP 6 dell’allegato ” Il percorso filosofico”).
Chimica
- Saggi alla fiamma;
- atomo di Bohr;
- energie di ionizzazione.
Risorse necessarie
Saggi alla fiamma
- Fornello bunsen, fili di platino o di nichel-cromo innestati su apposito supporto o su bacchetta di vetro, porta provette, provette, vetrini da orologio o piccoli contenitori di vetro;
- spettroscopi;
- Acido cloridrico 6M, cloruro di litio, cloruro di sodio, bicarbonato di sodio, cloruro di potassio, nitrato di potassio, cloruro di calcio, cloruro di bario, cloruro di stronzio, nitrato di stronzio, cloruro di rame(II), ossido di rame(II), nitrato di rame (I), polvere di rame, cloruro di manganese (possono essere utilizzati anche sali di altri metalli).
Energie di ionizzazione
- Computer con programma Excel o similare
Prerequisiti necessari
- Conoscenza dell’esperimento 21-Scienze “La materia continua o discontinua”;
- saper costruire grafici con Excel.
Obiettivi di apprendimento
Filosofia
- Conoscere il lessico specifico (acquisire, comprendere, utilizzare correttamente termini quali atomo, vuoto, moto, divenire, potenza/atto, meccanicismo, finalismo, qualità oggettive/qualità soggettive….);
- conoscere i nuclei tematici fondamentali del pensiero degli autori considerati, in relazione alla indagine sul mondo fisico (esempio: caratteri della fisica democritea, dottrina aristotelica del divenire, teoria dei ‘luoghi naturali’..);
- individuare differenze e affinità tra le concezioni cosmologiche / i modelli interpretativi relativi alla natura sviluppatisi in età antica;
- comprendere il rapporto tra scienza e filosofia nella cultura greca antica;
- acquisire/potenziare le capacità di: argomentare razionalmente; analizzare e leggere criticamente un testo filosofico (individuazione della tematica centrale, delle parole-chiave, delle tesi sviluppate, delle argomentazioni addotte a sostegno);
- stabilire confronti tra sistemi teorici differenti;
- educare al confronto razionale delle idee;
- acquisire un punto di vista prospettico e antidogmatico;
- interrogarsi in modo critico sul significato della realtà.
Chimica
- Costruire modelli interpretativi diversi e complessi;
- trasferire le conoscenze in contesti diversi;
- saper riconoscere i percorsi storici nella costruzione delle conoscenze scientifiche;
- interagire criticamente nel rispetto delle opinioni altrui;
- comunicare in modo efficace e rigoroso;
- saper costruire grafici e interpretarli;
- individuare la relazione fra la posizione occupata nella Tavola Periodica e la configurazione elettronica degli elementi.
Dotazioni di sicurezza
Dovendo usare un fornello Bunsen (fiamma libera) è preferibile che l’esperienza sia svolta al banco cattedra dall’insegnante o dal tecnico. Per l’acido cloridrico occorre essere dotati di schede di sicurezza. Se si volesse, comunque, far eseguire agli studenti l’esercitazione occorre che siano dotati dell misure di sicurezza individuali: camice, guanti, occhiali, capelli legati.
Svolgimento
Introduzione
I saggi alla fiamma permettono di osservare fenomeni luminosi legati alla struttura atomica. Un elemento emette luce di identico colore, in qualunque modo si trovi combinato, quando viene sottoposto al calore di una fiamma. Se la luce viene scomposta nelle sue componenti si evidenzia uno spettro di emissione caratteristico dell’elemento in questione. Vengono qui introdotte, o richiamate dalla fisica, conoscenze sulla natura della luce. Si passa dal modello ondulatorio a quello corpuscolare introdotto da Planck e utilizzato da Einstein per interpretare l’effetto fotoelettrico. Si pone l’accento sul “cambiamento di paradigma” necessario per mettere in relazione lo spettro di un atomo con la distribuzione degli elettroni operata da Bohr. Non potendo affrontare una trattazione quantomeccanica approfondita, vengono utilizzate le Energie di ionizzazione di alcuni atomi per introdurre livelli e sottolivelli. Si chiarisce, comunque, agli studenti che, quelli che stanno elaborando, sono dati ottenuti successivamente all’elaborazione del modello e ne rappresentano una conferma. Si passerà successivamente alla costruzione delle configurazioni elettroniche degli elementi e alla loro messa in relazione con la posizione occupata nella Tavola Periodica. Quest’ultima rappresenta una conferma “a priori” del modello atomico sviluppato.
Esecuzione dei saggi alla fiamma
Poiché i cloruri dei metalli sono più volatili e danno colorazioni più intense, si usa inumidire la sostanza in esame in acido cloridrico concentrato.
- Il filo di platino o di nichel-cromo (fissato all’apposito supporto o saldato in cima ad una bacchetta di vetro) deve essere perfettamente pulito prima di ogni saggio. A questo scopo va bagnato ripetutamente in acido cloridrico concentrato ed esposto alla fiamma fino a che non appaia alcuna colorazione. Sarebbe preferibile usare fili diversi per ogni sostanza. Si possono preparare fondendo brevemente la punta di una bacchetta di vetro e inserendovi un pezzetto di filo.
- Il filo pulito viene bagnato in acido cloridrico e immerso nella sostanza da saggiare, precedentemente posta in un vetrino da orologio o in un contenitore di vetro, in modo che una piccola quantità di essa aderisca alla punta del filo.
- Si porta la sostanza a contatto con la fiamma, inizialmente nella zona alla base di questa poi, quando la colorazione diventa meno evidente, nella zona più calda della fiamma ossidante.
- Avendo a disposizione dei piccoli spettroscopi si possono direzionare prima sulla luce bianca di una lampadina per osservare uno spettro continuo, poi sulle fiamme colorate del bunsen. Se lo strumento è molto semplice, come quello in figura, è piuttosto difficile ottenere gli spettri di molti elementi. Si vedono bene le righe del sodio e del rame perché le loro fiamme sono abbastanza persistenti.
.png)
- N. B. La colorazione del sodio è molto persistente e visibile anche in tracce minime. Nel caso si avesse a disposizione un solo filo, poiché la pulizia dalle tracce di sodio può risultare abbastanza lunga, conviene eseguire questo saggio per ultimo.
.png)
Domande per gli studenti:
- Ricordando la relazione esistente fra energia della radiazione luminosa e frequenza, quale significato è possibile attribuire alle righe spettrali di un elemento? Rappresentano radiazioni elettromagnetiche a diversa frequenza e quindi a diversa energia.
- Da cosa dipende il fatto che lo spettro del rame in polvere e identico a quello dell’ossido rameico, del cloruro rameico e del nitrato rameico? e quello del cloruro di sodio è identico a quello del bicarbonato di sodio? ecc. Un elemento in qualsiasi modo sia combinato emette lo stesso tipo di radiazioni, che rappresentano, quindi, la sua caratteristica peculiare (impronta).
- Dopo aver confrontato gli spettri di emissione e di assorbimento di alcuni elementi, quali regolarità puoi individuare? Lo spettro di assorbimento è complementare a quello di emissione; un atomo assorbe la energia con la stessa lunghezza d’onda che è in grado di emettere.
- Ricordando il modello atomico proposto da Rutherford, secondo te, con quale particella subatomica è più probabile che siano in relazione queste energie? come mai? E’ probabile che siano in relazione con la distribuzione degli elettoni, dato che essi rappresentano la parte più esterna dell’atomo e sono in continuo movimento.
- Secondo te, quale interpretazione è possibile dare di questi fenomeni? la risposta a questa domanda è difficile e complessa, ma porla agli studenti e farli cimentare in una risposta ha lo scopo di motivare e stimolare al lavoro successivo sul modello atomico di Bohr.
Atomo di Bohr: filmati
La trattazione del modello atomico di Bohr verrà sviluppata attraverso la visione dei filmati citati nella bibliografia.
Energie di ionizzazione: Verifica del modello atomico a livelli e orbitali
L’ energia di ionizzazione
Attraverso l’uso delle energie di ionizzazione è possibile giustificare la distribuzione degli elettroni sui livelli energetici e sui sottolivelli o orbitali, in questo caso fino all’individuazione del sottolivello d.
Dopo aver costruito i grafici relativi alle energie di ionizzazione proposte in tabella, gli allievi dovranno individuare le regolarità che le distribuzioni suggeriscono nella corrispondente struttura elettronica degli elementi, tenendo conto dei seguenti principi generali che derivano dalla forza di Coulomb:
\(E_i\) cresce con il numero di protoni presenti nel nucleo;\(E_i\) cresce man mano che gli elettroni sono più vicini al nucleo;\(E_i\) cresce quando da uno stesso livello si allontanano, successivamente, più elettroni.
Gli studenti dovranno quindi:
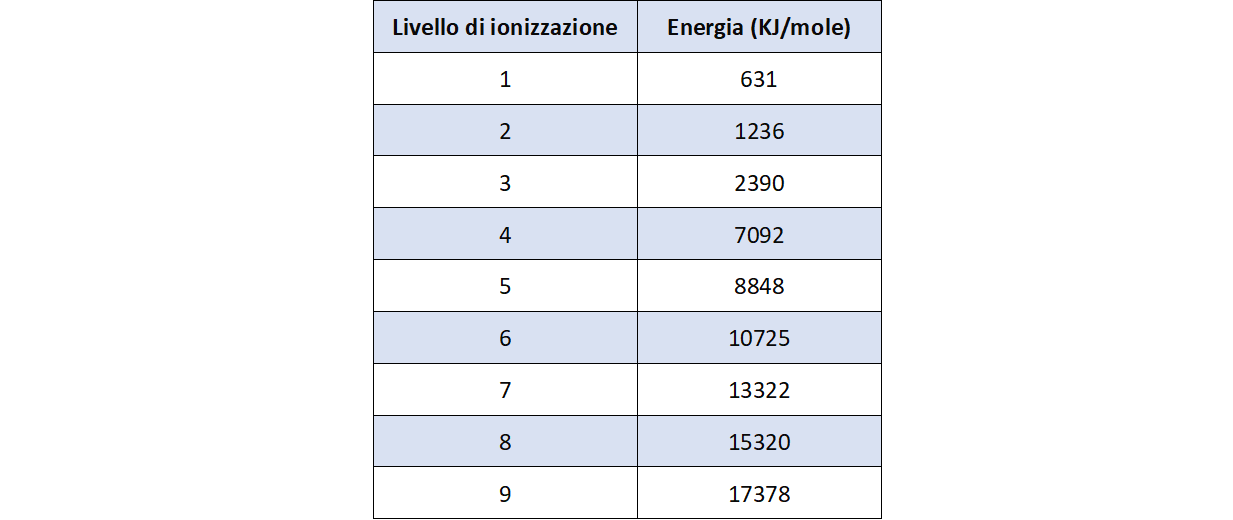
- Considerare la tabella 2 che riporta i valori di energia di ionizzazione per i 18 elettroni dell’argon partendo dagli elettroni più esterni;
- Costruire il grafico: energia di ionizzazione in funzione del livello di ionizzazione per i 18 elettroni;
- Costruire il grafico: energia di ionizzazione degli otto elettroni più esterni in funzione del livello di ionizzazione;
- Costruire il grafico: energia di ionizzazione dei sei elettroni più esterni in funzione del livello di ionizzazione;
- Costruire il grafico: energia di ionizzazione della seconda serie di otto elettroni.
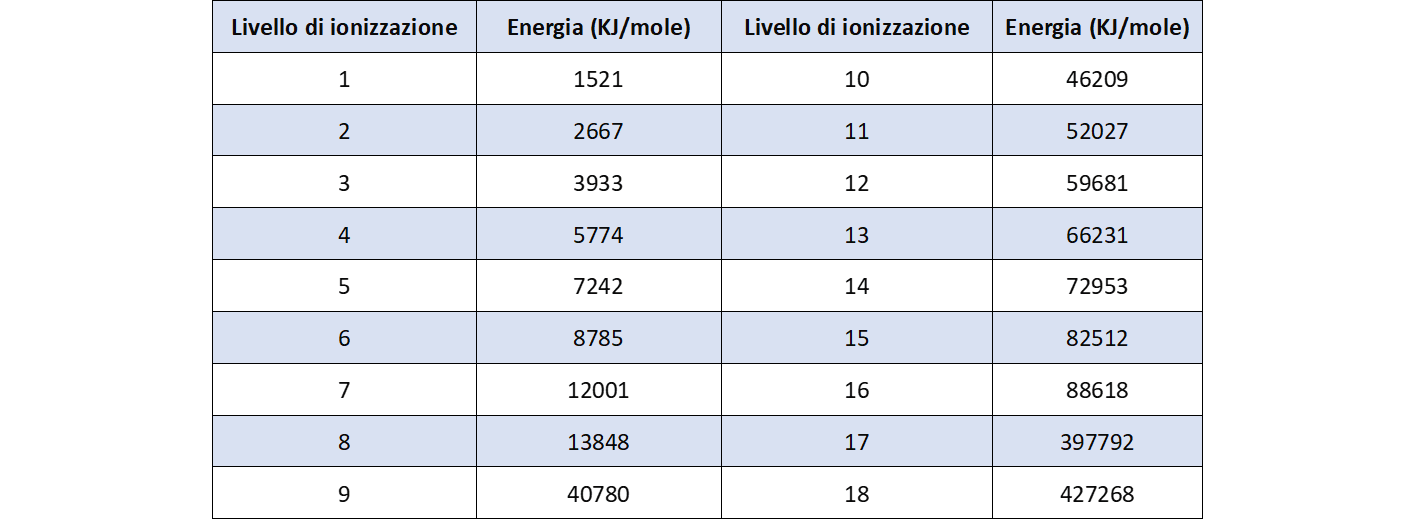
Domanda per lo studente: Quale distribuzione degli elettroni nell’atomo di argon si può dedurredal grafico di figura 3? E’ possibile evidenziare almeno tre differenti livelli nella distribuzione degli elettroni: un livello più interno, occupato da due elettroni, due successivi livelli, uno intermedio e uno esterno, occupati da otto elettroni ciascuno.
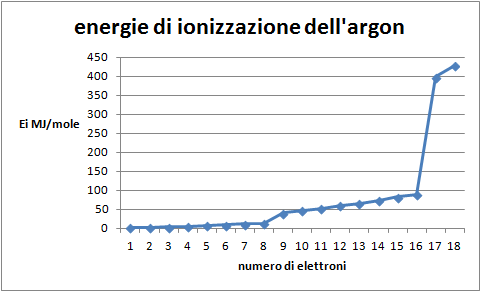
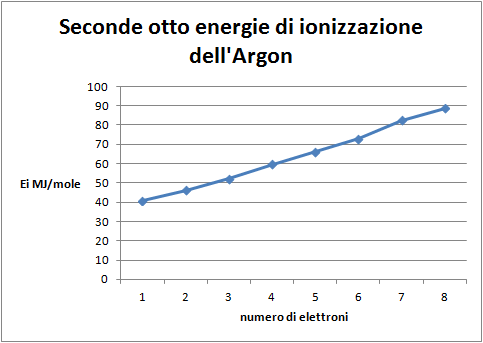
Domanda per lo studente: Quale distribuzione degli elettroni nell’atomo di argon si può dedurredal grafico delle prime otto energie di ionizzazione (figura 4)? E’ possibile evidenziare due differenti sottolivelli nella distribuzione degli elettroni: uno più interno, occupato da due elettroni, il sottolivello s, uno più esterno che contiene sei elettroni, il sottolivello p, a sua volta, differenziato in due gruppi di tre elettroni.
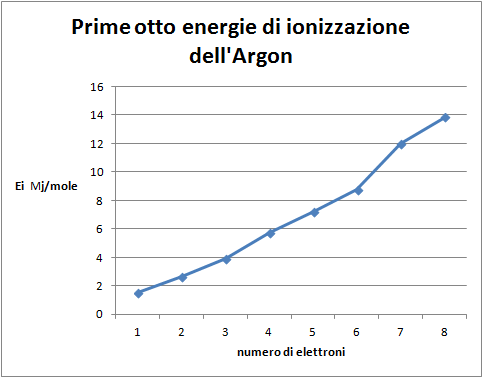
Domanda per lo studente: Quale distribuzione degli elettroni nell’atomo di argon si può dedurredal grafico delle prime sei energie di ionizzazione (figura 5)? Si confermano due serie di tre elettroni. Introducendo il concetto di spin si esclude la possibilità che esistano due sottolivelli che possono contenere tre elettroni ciascuno. Si ipotizzano tre sottolivelli energeticamente equivalenti, (px, py ,pz) che vengono riempiti secondo la regola di Hund della massima molteplicità. Questo fatto giustifica la linearità delle prime tre energie di ionizzazione e lo sfalsamento rispetto alle seconde tre; infatti entra in gioco la repulsione tra elettroni nello stesso livello che giustifica il salto nell’energia necessaria.
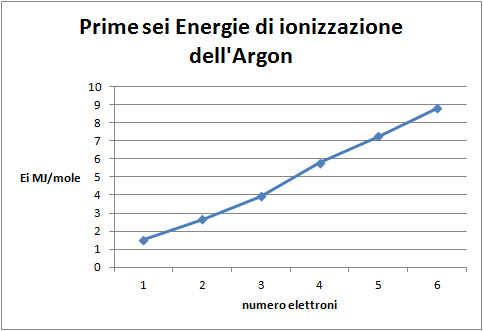
Domande per lo studente: Quale distribuzione degli elettroni nell’atomo di argon si può dedurredal grafico delle seconde otto energie di ionizzazione (figura 6)? In che relazione sono con il primo gruppo di otto? L’andamento di questo secondo ottetto è identico al primo, per cui si può ipotizzare la stessa distribuzione degli elettroni intorno all’atomo
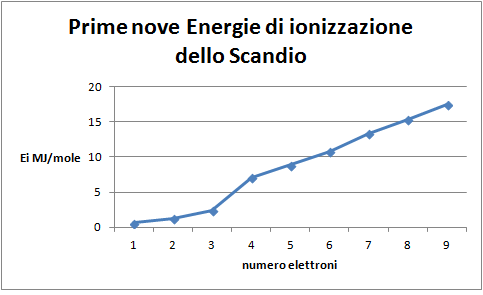
6. Costruire il grafico delle prime nove energie di ionizzazione dello scandio in funzione del livello di ionizzazione
Domanda per lo studente: Quale distribuzione degli elettroni nell’atomo di scandio si può dedurre dal grafico delle prime nove energie di ionizzazione dello Scandio (figura 7)? Si introduce tra i due elettroni del sottolivello s e i sei del sottolivello p un singolo elettrone che potrebbe preludere alla esistenza di una serie di elettroni nuova rispetto alle precedenti, dato che la posizione di questo elettrone risulta non allineata, né con quella degli elettroni s, né con quella dei p.
7. Costruire il grafico delle prime nove energie di ionizzazione del cobalto in funzione del livello di ionizzazione.
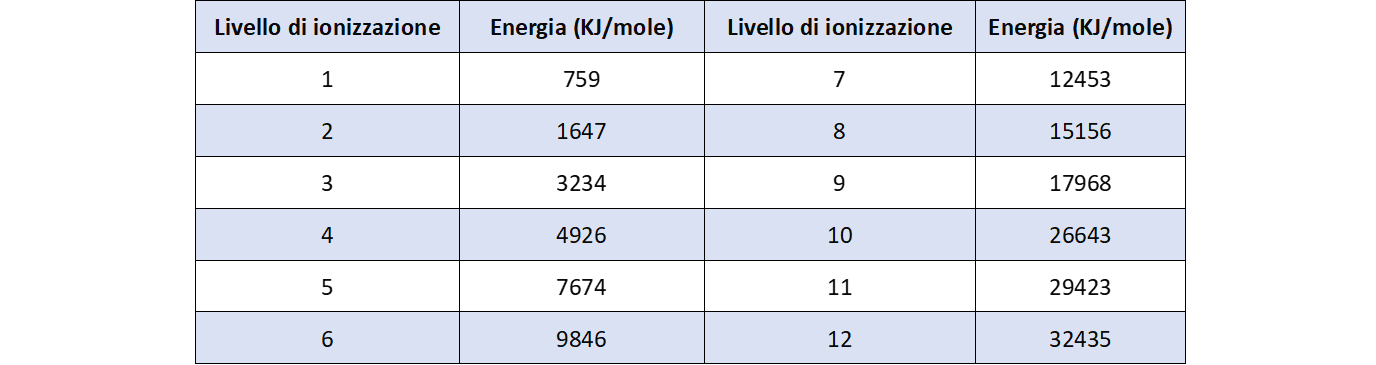
Domanda per lo studente: Quale distribuzione degli elettroni nell’atomo di cobalto si può dedurre dal grafico delle prime nove energie di ionizzazione (figura 8)? Dall’esame si evidenzia una frattura tra i primi due elettroni appartenenti ad un sottolivello s e i successivi sette, all’interno dei quali, una ulteriore frattura fra il secondo e il terzo suggerisce una situazione simile a quella presentata dagli elettroni del sottolivello p; questa volta, però, i gruppi sembrano essere formati da cinque elettroni e pertanto i sottolivelli corrispondenti devono essere cinque: serie degli elettroni d.
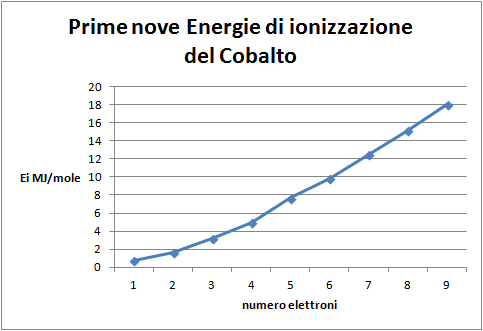
A questo punto vengono introdotte le configurazioni elettroniche degli atomi e le si mette in relazione con la posizione degli stessi nella tavola periodica: corrispondenza fra livelli/periodi e sottolivelli/gruppi con il relativo ordine di riempimento. Come conferma si chiede di costruire il grafico delle dodici energie di ionizzazione del cobalto.
Domanda per lo studente: Confronta questo grafico con quello precedente; cosa suggerisce il salto fra le prime 9 Energie di ionizzazione e le ultime 3 sulla distribuzione degli elettroni (figura 9)? Cerca sulla tavola periodica la posizione del Cobalto e confrontala con la distribuzione dei suoi ultimi elettroni. Quali conferme se ne possono trarre? Il Cobalto è situato nel gruppo 9 del quarto periodo, pertanto le prime 9 Ei rappresentano i suoi elettroni più esterni situati in questo periodo. Le ultime 3 Ei rappresentano elettroni situati nel terzo periodo, da qui il salto energetico dopo le prime 9 Ei.
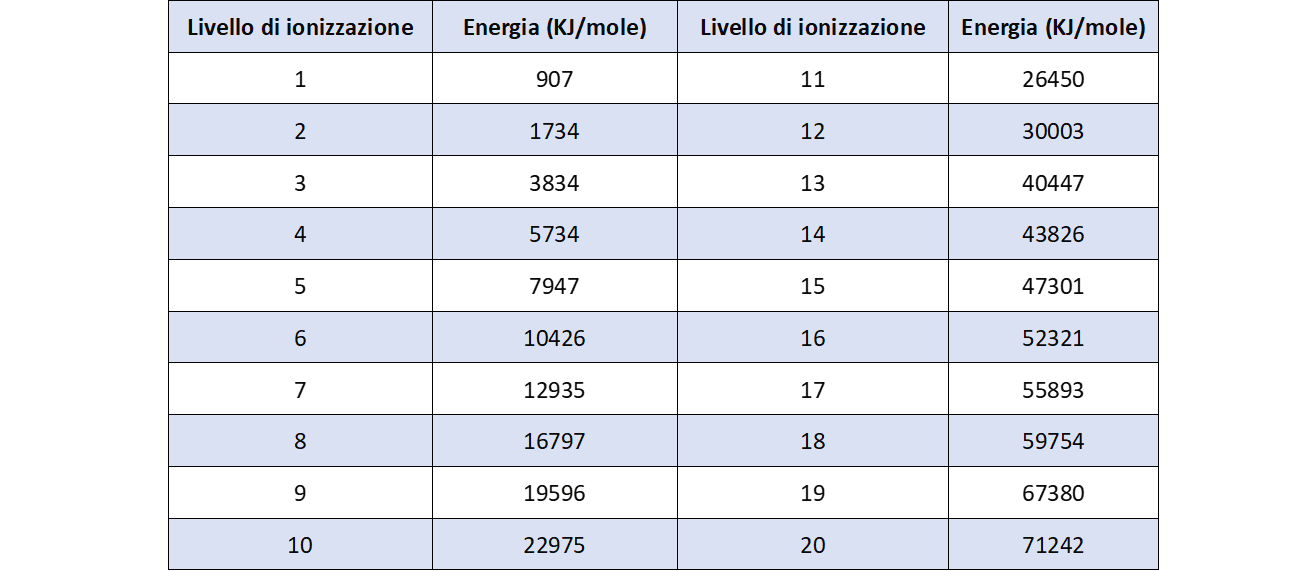
Un’esercitazione ulteriore può essere proposta con le prime 20 energie di ionizzazione dello zinco, di cui si riportano i valori in tabella. Anche in questo caso viene chiesta la correlazione con la configurazione elettronica dell’elemento e la sua posizione nella tavola periodica.
Note e storia
Indicazioni sulla fiamma del Bunsen
La fiamma della lampada Bunsen presenta zone a temperatura e comportamenti diversi. Si distinguono principalmente una zona esterna (o mantello esterno), in cui il gas brucia con eccesso di aria e la fiamma è ossidante e raggiunge un’alta temperatura, e una zona interna (o mantello interno), in cui si ha un insufficiente apporto di aria e una combustione incompleta pertanto la fiamma è riducente e poco calorifica. Mediante la ghiera alla base del fornello, è possibile regolare l’immissione di aria insieme al gas e rendere la fiamma prevalentemente ossidante e calorifica (fiamma azzurra) oppure riducente e poco calorifica (fiamma luminosa e carboniosa).
Per la ricostruzione del percorso storico si rinvia alla visione dei filmati proposti in bibliografia.
Il modello epistemologico di T.S.Kuhn fa da sfondo a tutto il percorso e ne rappresenta l’ipotesi interpretativa. In particolare per il passaggio dal modulo ” La materia continua o discontinua” al secondo modulo ” L’energia continua o quantizzata” si fa riferimento al testo ” La struttura delle rivoluzioni scientifiche” pp da 49 a 58, che tratta in specifico la “rivoluzione” operata da Plank e utilizzata da Bohr.
Per poter affrontare un percorso interdisciplinare è importante, oltre alla contemporaneità, che gli insegnanti delle discipline coinvolte conoscano i contenuti reciproci e soprattutto che ne condividano la terminologia. Ciò non significa che l’insegnante di scienze possa o debba insegnare filosofia, e viceversa, ma è importante, come ed esempio in questo caso, che termini come “modello”, “paradigma”, “anomalia”, “periodi rivoluzionari”, “periodi di scienza normale”, ecc., siano utilizzati durante le spiegazioni e introdotti nelle discussioni in modo da rafforzare l’apprendimento interdisciplinare. Il percorso storico della scienza rappresenta la base della riflessione filosofica; la trattazione filosofica introduce all'”epistemologia” della disciplina scientifica e sviluppa competenze metacognitive.
Bibliografia
- G.Valitutti, A.Tifi, A. Gentile Esploriamo la chimica Zanichelli;
- J.E. Brady, F. Senese Chimica Zanichelli;
- G. Bulgarelli Guida al laboratorio di chimica Edizioni Clio;
- Rivista “DIDATTIDA DELLE SCIENZE” Ed. La scuola”/numero 193/gennaio 1998 ” Le strutture elettroniche degli elementi”;
- http://www.youtube.com/watch?v=r9wKjub7x38 l’atomo di Bohr;
- http://www.youtube.com/watch?v=Z5-6YsJVFcE&list=PLpX7lEyPPR5uc7BxbnttuF6x35tsvW104.
Autori
Giovanelli Carmen
Vigati Attilia
Colombo Rosangela
Macchi Emanuela
Schede / Allegati
Prove di verifica
Specifiche esperimentoMateria Chimica Classi a cui è rivolto 2° biennio Tipologia di laboratorio Strumentazione semplice Reperibilità del materiale Negozi specializzati, siti web Materiale specifico Vetreria da laboratorio, acido cloridrico, vari sali di metalli, becco Bunsen Durata esperimento in classe 2 h Capacità di bricolage/assemblaggio No Necessità lavorazioni meccaniche/elettroniche No Necessità PC per acqusizione/analisi dati No Necessità di uno smartphone No Parole chiave Chimica Filosofia Struttura atomica Atomo di Bohr |