Riassunto / Abstract
Questa attività vuole verificare, attraverso una reazione chimica di facile realizzazione, la legge di Lavoisier, ovvero il principio della conservazione della massa. Gli studenti potranno vedere che si tratta effettivamente di una trasformazione chimica, grazie alle variazioni cromatiche e allo sviluppo di effervescenza che si verificano durante la reazione stessa e, nello stesso tempo, prendere nota del fatto che la massa, prima e dopo la reazione, non varia.
Scheda sintetica delle attività
Gli studenti vengono divisi in piccoli gruppi. Ogni gruppo deve “sciogliere” il contenuto di una bustina di “Frizzina” (comune preparato per acqua da tavola facilmente reperibile in commercio contenente carbonato acido di sodio, acido malico e acido tartarico) in acqua, osservare le trasformazioni durante la reazione e verificare che la somma delle masse prima e dopo la reazione resta invariata. Le osservazioni e i dati, raccolti in tabella, vengono commentati insieme.
Risorse necessarie
- 1 bottiglia vuota in plastica da 0,5 L con tappo;
- 4-5 gocce di indicatore universale;
- 1 provetta di vetro che entri “comodamente “ nella bottiglia;
- 1 spruzzetta contenente acqua distillata;
- un pezzetto di parafilm;
- 1 bustina di “Frizzina”;
- bilancia tecnica.
Prerequisiti necessari
Conoscenza della grandezza massa e delle sue unità di misura;
concetto generale di reazione chimica;
concetto di indicatore di pH ( per la classe
uso della bilancia tecnica.
Obiettivi di apprendimento
Saper operare con precisione nella determinazione della massa;
saper osservare un fenomeno in corso prendendo nota di tutti gli eventi salienti;
capire il principio di “conservazione della massa”.
Dotazioni di sicurezza
Nessuna
Svolgimento
Realizzazione delle misure
- Misurare una quantità di acqua pari a circa 1/5 ( circa 100 mL ) della capacità della bottiglia.
- versare nella provetta di vetro metà del contenuto della bustina di “Frizzina”;
- far scivolare lentamente la provetta dentro la bottiglia di plastica senza far venire a contatto la “Frizzina” con l’acqua;
- aggiungere nell’acqua 4 o 5 gocce di indicatore universale e osservare la colorazione assunta dall’acqua;
- chiudere bene la bottiglia e avvolgere il parafilm intorno al tappo in modo che la chiusura sia il più possibile ermetica, per impedire la fuoriuscita degli eventuali gas prodotti;
- pesare sulla bilancia tecnica tutto il sistema e annotare il valore ottenuto;
- dopo aver pesato, capovolgere la bottiglia in modo tale che il contenuto della provetta di vetro venga a contatto con l’acqua e osservare nuovamente il colore assunto dall’acqua;
- quando la reazione tra acqua e la “Frizzina” è finita, misurare alla bilancia la massa di tutto il sistema e annotare il valore ottenuto;
- togliere parafilm e tappo e aspettare qualche minuto, ed osservare ancora una volta il colore assunto dall’acqua;
- riportare il sistema alla bilancia e misurare nuovamente la massa (incluse quella del parafilm e del tappo) annotando il valore.

I dati misurati e le osservazioni fatte sono riassunte in tabella 1.
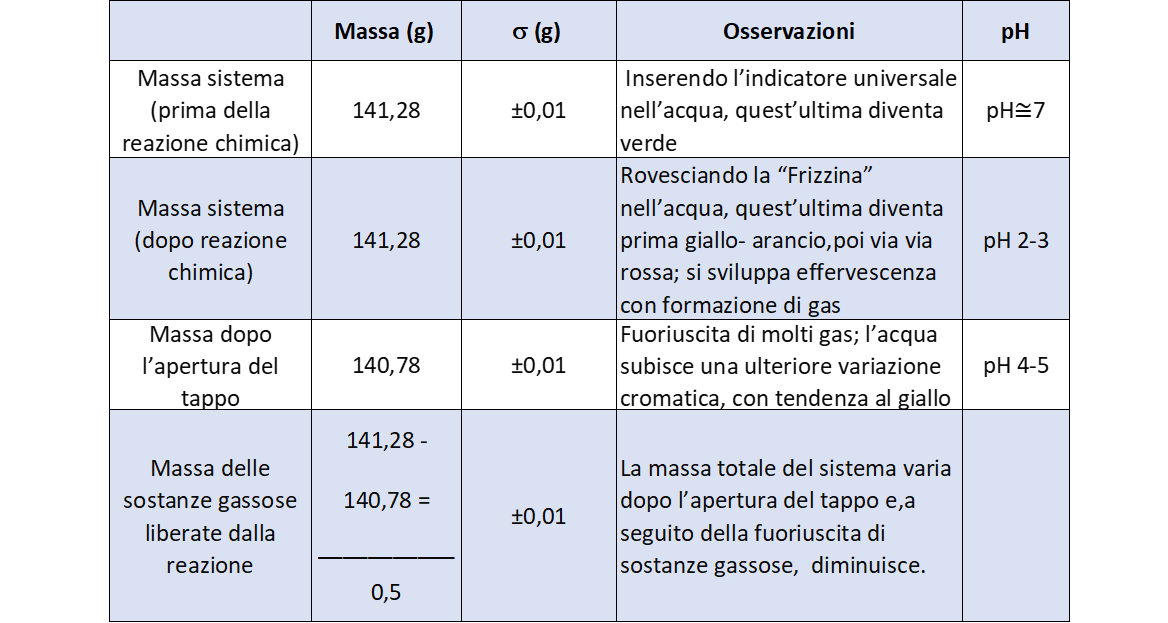
Discussione
L’obiettivo di questa esperienza è soprattutto quello di far comprendere in modo pratico il significato della legge della conservazione della massa: «In una reazione chimica la massa complessiva dei reagenti è uguale alla massa complessiva dei prodotti» (vedi http://it.wikipedia.org/wiki/Legge_della_conservazione_della_massa_(chimica)). L’enunciato della legge di Lavoisier è, dal punto di vista teorico, di facile acquisizione per i ragazzi ma la comprensione dei fenomeni che accompagnano una semplice trasformazione chimica non è scontata. Sarà quindi importante invitare ogni gruppo a raccogliere tutte le osservazioni fatte durante l’esperienza e, a questo proposito, potrà essere utile stimolare la loro attenzione con alcune domande che facciano riflettere sui cambiamenti osservati (per esempio: perchè la soluzione cambia colore? cosa succede se comprimiamo la bottiglia? ecc.). Ogni gruppo annoterà le osservazioni e le misurazioni su una tabella come quella riportata sopra.
Al termine dell’esperienza l’insegnante commenterà i risultati mettendo a confronto il lavoro dei diversi gruppi e soffermandosi sugli aspetti fondamentali.
Nelle classi prime la discussione verrà condotta sui seguenti punti:
- il cambiamento di colore della soluzione come conseguenza della reazione chimica
- la produzione di gas, anidride carbonica, come esempio di prodotto della reazione che i ragazzi sono in grado di evidenziare sulla base della incomprimibilità della bottiglia (aumento di pressione, il gas c’è ma non si vede)
- la conservazione della massa che si verifica solo se il contenitore è chiuso.( a questo proposito è possibile introdurre il concetto di sistema chiuso, la trasformazione non scambia materia con l’ambiente esterno). Eventuali variazioni della misura della massa vengono facilmente giustificate dai ragazzi come difetto nella chiusura della botttiglia o errore della misura dovuto allo strumento
- le conseguenze dell’apertura della bottiglia: diminuzione della massa, che i ragazzi giustificano con la fuoriuscita di gas, e un nuovo cambiamento di colore della soluzione associato ad un’ulteriore trasformazione chimica.
La discussione nelle classi seconde potrà essere completata con le seguenti ulteriori considerazioni:
- il cambiamento di colore della soluzione è associato ad un cambiamento di pH dovuto all’acido carbonico prodotto dalla reazione tra l’anidride carbonica e l’acqua.
- la successiva variazione di pH a seguito dell’apertura della bottiglia è dovuto alla perdita di anidride carbonica e quindi alla diminuzione di acido carbonico in soluzione ( a questo proposito è possibile introdurre il concetto di reversibilità di reazione, i ragazzi notano che il colore torna lentamente quello di partenza).
La discussione dei fenomeni osservati e la loro interpretazione rappresenta per gli studenti del primo biennio un esempio rigoroso di analisi qualitativa e quantitativa delle trasformazioni chimiche.
Bibliografia
Autori
Concari Elisabetta
Prove di verifica
Specifiche esperimentoMateria Chimica Classi a cui è rivolto 1° biennio Tipologia di laboratorio Povero Reperibilità del materiale Uso quotidiano, negozi specializzati, siti web Materiale specifico Vetreria da laboratorio, bilancia, bustina di polvere per rendere l’acqua frizzante, bottiglia di plastica Durata esperimento in classe 1 h Capacità di bricolage/assemblaggio No Necessità lavorazioni meccaniche/elettroniche No Necessità PC per acqusizione/analisi dati No Necessità di uno smartphone No Parole chiave Chimica Reazioni chimiche Bilanciamento di reazioni Legge di Lavoisier |