Riassunto / Abstract
L’esperimento si inserisce nel programma di biotecnologia delle classi quinte con l’obiettivo di sviluppare una conoscenza di base della tecnica del DNA Fingerprinting.
Viene simulata una scena del crimine in cui, a seguito di un omicidio, viene rinvenuta un’arma con delle tracce di sangue sull’impugnatura. Sono inoltre identificati tre sospettati, a cui viene eseguito un tampone boccale per l’analisi del DNA.
Gli studenti hanno il compito di identificare il colpevole del delitto mediante la comparazione dei profili genetici ottenuti analizzando le tracce di materiale genetico rinvenute sulla scena del crimine e i campioni di DNA della vittima e dei possibili sospettati, per trovare eventuali corrispondenze.
Scheda sintetica delle attività
Il DNA fingerprinting (o impronta genetica o DNA profiling) è una tecnica ampiamente usata, dall’ambito medico a quello forense, per l’idenitificazione di un soggetto.
L’esperimento ripropone i passaggi principali dei primi test di fingerprinting che consistevano in: digestione con enzimi di restrizione, elettroforesi e successiva visualizzazione delle bande di DNA.
Il DNA fingerprinting si basa sull’analisi di marcatori STR (Short Tandem Repeats o microsatelliti) presenti nel genoma di ogni individuo. Gli STR consistono di brevi sequenze di DNA (10-50 paia di basi) ripetute in tandem numerose volte e presenti in diversi cromosomi. Il numero di ripetizioni è altamente variabile nei diversi individui, ma è costante in ogni profilo e segue un pattern di ereditarietà mendeliana.
L’analisi di sequenze STR può essere effettuata mediante il taglio del DNA con enzimi di restrizione (particolari proteine capaci di tagliare la molecola del DNA in siti specifici). Si ottengono in questo modo frammenti di DNA di diversa lunghezza, contenenti sequenze STR, che possono essere separati tramite elettroforesi su gel di agarosio.
L’elettroforesi è una tecnica che permette di separare frammenti di acido nucleico, in funzione del loro peso molecolare. Frammenti di DNA (carichi negativamente per la presenza dei gruppi fosfato) in un campo elettrico migrano verso il polo positivo e migrano tanto più velocemente quanto più sono piccoli.
In questo modo dal DNA è possibile ottenere un profilo genetico specifico per ciascun individuo e quindi confrontare il profilo genetico della scena del crimine con quello dei sospettati ed arrivare ad identificare il colpevole.
La tecnica è piuttosto lunga e complessa e prevede dei tempi di attesa nei quali l’insegnante spiega e approfondisce la parte teorica della metodica.
Il caso proposto
Tra giovedì e venerdì nell’edificio del liceo è stato commesso un omicidio. Il sabato mattina è stato trovato il cadavere di un collaboratore scolastico. Il medico legale ha riscontrato sul cadavere numerose ferite da arma da taglio e durante il sopralluogo della scena del crimine è stato rinvenuto un coltello con tracce di sangue sull’impugnatura, che sono state repertate e prelevate (figura 1). Le indagini eseguite hanno permesso di identificare tre sospettati che erano presenti nell’edificio nelle ore compatibili con il delitto.
Tutti e tre si sono dichiarati innocenti, per cui a ciascuno di essi è stato eseguito un tampone boccale per l’analisi del DNA.
I reperti della scena e dei sospettati sono stati quindi consegnati alle squadre scientifiche (RIS e Polizia scientifica), impersonate dai 6 gruppi di studenti di una classe, per la comparazione dei profili genetici mediante DNA Fingerprinting.

Risorse necessarie
Materiali e strumentazione:
- camera per elettroforesi orizzontale con vassoio (15×7) e con pettine per 20 pozzetti (in numero di 2 camere per far lavorare 6 gruppi di alunni contemporaneamente);
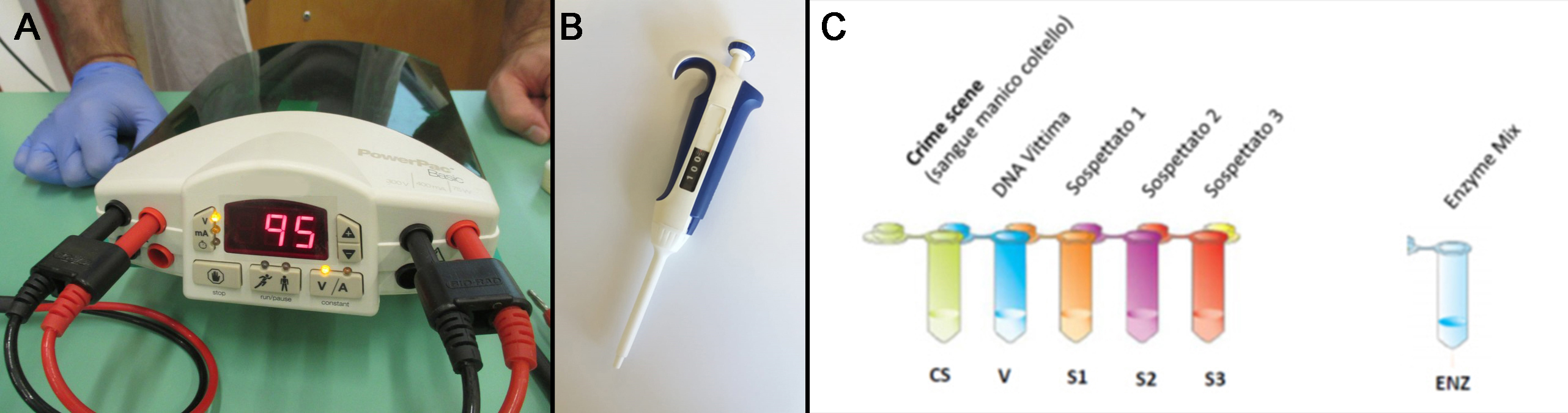
- alimentatore per elettroforesi (per alimentare due camere) (figura 2A);
- piastra riscaldante magnetica o forno a microonde (per preparare il gel di agarosio);
- incubatore (o yogurtiera) (per far agire gli enzimi di restrizione);
- minicentrifuga (non è indispensabile, al suo posto si possono «flinkare» le eppendorf);
- micropipette 20-200 µl (almeno 2 – una per camera-, ma meglio 6 -una per gruppo-) (per prelevare i campioni di DNA) (figura 2B)
- puntali adatti alle micropipette.
Per ogni gruppo:
- 1 rack porta provette;
- un pennarello indelebile;
- 1 provetta enzime mix (ENZ) in ghiaccio;
- 1 vaschetta 7×8 cm (per sciacquare il gel colorato e tagliato in tre parti);
- 1 provetta con colorante Orange e provette vuote (per imparare ad utilizzare le micropipette):
- 5 provette (eppendorf) colorate con DNA (figura 2C):
- della scena del crimine (SC);
- della vittima (V);
- del sospettato 1 (S1);
- del sospettato 2 (S2);
- del sospettato 3 (S3) ;
Reagenti (presenti nel kit didattico):
- enzimi di restrizione in mix;
- loading DYE (LD) (tampone di caricamento per elettroforesi: colorante + addensante);
- agarosio in polvere (per preparare il gel);
- TAE 1X (Tris-Acetato EDTA) (è un buffer con potere tamponante e che conduce corrente elettrica);
- fast Blast DNA stain a concentrazione 100x (è il colorante che permette di visualizzare la corsa elettroforetica senza aver bisogno del transilluminatore);
- acqua sterile.
Prerequisiti necessari
- Conoscere la struttura del DNA;
- sapere che il DNA viene comunemente estratto da diverse tracce organiche rilevate sulla scena del crimine: sangue (globuli bianchi), saliva, sudore, capelli, sperma …;
- conoscere gli enzimi di restrizione;
- saper preparare una soluzione.
Obiettivi di apprendimento
- Conoscere nel genoma umano la presenza di sequenze polimorfe STR, che essendo di grandezza diversa permettono di identificare in modo univoco un individuo;
- comprendere che il gel di agarosio è una sorta di setaccio che viene sfruttato per separare fra di loro e visualizzare i frammenti di DNA;
- saper preparare il gel di agarosio;
- imparare ad utilizzare le micropipette;
- comprendere la tecnica dell’elettroforesi;
- venire a conoscenza che l’FBI utilizza 13 STR disposti nei diversi cromosomi umani;
- confrontare le dimensioni dei frammenti di DNA generati dalla digestione enzimatica.
Dotazioni di sicurezza
- Guanti monouso;
- camice da laboratorio.
Svolgimento
Preparazione
Prima dell’esperimento vero e proprio con i ragazzi, il tecnico di laboratorio deve fare varie azioni preliminari:
- Reidratare i vari campioni di DNA (che è liofilizzato e tenuto in freezer).
- Reidratare il Ladder (DNA di taglia nota).
- Reidratare gli enzimi di restrizione.
- Aliquotare DNA per 6 postazioni (10 µl each).
- Aliquotare Loading Dye per 6 postazioni.
- Aliquotare enzimi di restrizione per 6 postazioni.
- Diluire TAE 1X.
- Diluire FAST BLAST DNA stain a 100X.
- Versare 2 gel 1% agarosio (volume circa 100 ml).
- Allestire le 6 postazioni per i 6 gruppi di studenti (figura 3).

L’esperimento si compone di quattro parti e necessita di tre ore di laboratorio che possono essere spezzate in due giorni diversi avendo l’accortezza di mantenere il gel umido:
I parte: reazione di digestione con enzimi di restrizione
II parte: preparazione del gel di agarosio
III parte: preparazione dei campioni e corsa elettroforetica
IV parte: colorazione del gel mediante Fast Blast DNA Stain
Prima di iniziare – uso della micropipetta: Si utilizza la ghiera per scegliere il volume da prelevare. Si inserisce il puntale monouso, si schiaccia fino al primo scatto il pulsante di aspirazione-rilascio del liquido, si immerge il puntale nel campione, si rilascia lentamente prelevando così il campione, si estrae il puntale ed infine, inserendolo nel pozzetto o nella eppendorf, si schiaccia fino al secondo scatto per far fuoriuscire il contenuto. Da ultimo si schiaccia il bottone di espulsione dei puntali.
I parte: reazione di digestione con enzimi di restrizione
1. Trasferire 10 μl di Enzyme Mix (provetta marcata ENZ) in ciascuna delle 5 eppendorf contenenti i seguenti DNA:
CS: crime scene (traccia ematica sul manico del coltello) (figura 4);
V: DNA estratto della vittima;
S1: sospettato 1;
S2: sospettato 2;
S3: sospettato 3.

ATTENZIONE:
- Sincerarsi che il campione di DNA sia sul fondo della provetta.
- Cambiare puntale per ogni campione.
- Pipettare più volte lentamente per mescolare il campione.
2. Chiudere bene le provette, «flickare» per mescolare, far scendere sul fondo la miscela di reazione mediante centrifugazione (o utilizzare la minicentrifuga) (figura 5)

3. Marcare le provette con il numero del gruppo, inserirle negli alloggiamenti galleggianti e incubare la reazione a 37°C per 45 min.
II parte: preparazione del gel d’agarosio
- Utilizzando le apposite barriere (in dotazione con alcune camere da elettroforesi e chiamate gel caster) o lo scotch di carta, sigillare entrambe le estremità di una vaschetta per gel. Inserire gli appositi pettini per la formazione dei pozzetti e assicurarsi che sia in posizione perfettamente orizzontale (in bolla).
- Per ottenere una concentrazione di agarosio del 1% p/v, mescolare in una beuta 1 g di agarosio (figura 6A) con 100 ml di TAE 1x (Tris-Acetato EDTA). Il TAE è una soluzione tampone ricca di sali, che serve per condurre la corrente elettrica e controllare il pH durante l’elettroforesi.
- Sciogliere l’agarosio in un forno a microonde o su una piastra riscaldante, mescolando di tanto in tanto e facendo attenzione a non far bollire la soluzione. L’agarosio si scioglie in acqua con temperature sopra i 70°C.
- Quando la soluzione sarà completamente trasparente, attendere qualche minuto per farla raffreddare fino a circa 50° (figura 6B).
- Versare il gel nell’apposita vaschetta con pettini, facendo attenzione a non formare bolle (figura 6C).
- Aspettare circa 30 minuti perché raffreddandosi il gel polimerizza.
- Una volta che il gel è polimerizzato, togliere le eventuali spondine utilizzate per contenere il gel, togliere il pettine per la formazione dei pozzetti e ricoprire il gel con il tampone di corsa TAE 1x (figura 6D).

III parte: preparazione del campioni e corsa elettroforetica
- Rimuovere i campioni dall’incubatore e se necessario centrifugarli.
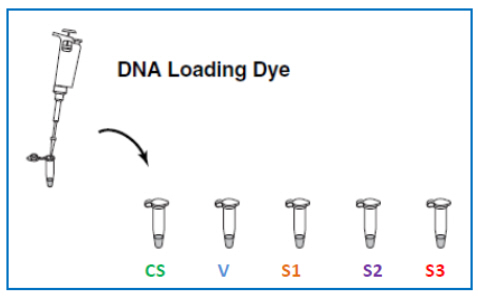
- Aggiungere 5 μl di “Loading Dye” (LD) in ciascuna delle 5 eppendorf contenenti i DNA (figura 7). Il LD è il tampone di caricamento costituito da un colorante blu + un addensante (glicerolo) che si aggiunge ai campioni prima dell’elettroforesi. Serve ad “appesantire” i campioni, permettendo la loro permanenza nei pozzetti e a fornire un marker visivo del progredire della corsa elettroforetica (segnala il fronte della corsa). Infatti poiché DNA è “trasparente”, se si caricassero i campioni sul gel senza il tampone, avviando l’elettroforesi non si riuscirebbe a rendersi conto di quanto si sono spostati i frammenti di DNA e si correrebbe il rischio di farli “uscire” dalla parte bassa del gel (magari perdendo delle bande importanti). Il LD è una sostanza colorata molto leggera e carica negativamente che migra più velocemente di qualunque frammento di DNA.
3. Mescolare pipettando o «flickando». Centrifugare se il campione è rimasto sulle pareti.
4. Caricare 20 μl di ciascun campione di DNA nei pozzetti del gel annotando l’ordine di caricamento e il gruppo (figura 8). Questa operazione è delicata perché se non si è pratici si rischia o di bucare il pozzetto o di rilasciare il DNA prima di entrare nel pozzetto. Quindi è preferibile in un momento precedente far esercitare gli alunni all’uso della micropipetta facendo prelevare piccoli quantitativi di una soluzione colorata (orange).

5. Chiudere il coperchio dell’alimentatore, accendere l’alimentatore e verificare il passaggio di corrente attraverso l’emissione di bolle in prossimità degli elettrodi (vedi figura). La corsa elettroforetica necessita di un voltaggio di circa 12-15 V/cm. Per un gel di 8 cm di lunghezza il voltaggio è di 100 V.
6. Quando il fronte di migrazione indicato dal Loading Dye (LD) raggiunge la fine del gel (circa 30 minuti) staccare l’alimentatore e procedere alla colorazione per la visualizzazione delle bande (figura 9).

IV parte: colorazione del gel mediante Fast Blast DNA Stain
- Una volta arrestata la corsa elettroforetica, estrarre il gel e immergerlo in una vaschetta contenete il colorante Fast Blast DNA ad una concentrazione di 100x per circa 2 minuti, agitando lentamente (figura 10).
- Trasferire il gel in un nuovo contenitore. Si suggerisce di tagliare ognuno dei due gel, ottenuti nelle due camere, in tre parti in modo tale che ogni gruppo abbia il proprio gel su un contenitore.
- Trasferire con cautela ogni porzione di gel in una vaschetta e sciacquarlo con acqua a 40–55°C per circa 10 secondi.
- Decolorare il gel mediante due lavaggi in acqua calda di 5 minuti ciascuno, sempre agitando lentamente e con cautela.

Osservazioni e conclusioni
Osservare dopo un po’ la comparsa delle bande (figura 11). Confrontare il profilo genetico della scena del crimine con quello dei tre sospettati. Qui a fianco il risultato su gel di agarosio colorato:il profilo genetico della scena del crimine (SC) (tracce di materiale organico lasciate dall’assassino -diverse da quelle della vittima V) è combaciante con il profilo genetico del secondo sospettato (S 2) che è il colpevole; sono scagionati i sospettati S1 e S3.In realtà se si osserva il risultato il giorno dopo le bande si evidenziano meglio, col tempo il gel si asciuga e lo si può conservare come materiale didattico per farlo vedere anche ad altre classi, che non hanno potuto fare l’esperienza diretta.

Note e storia
Negli ultimi anni, la genetica ha acquisito sempre più importanza nell’ambito delle scienze forensi. Questo grazie all’accrescimento delle conoscenze sul genoma umano e allo sviluppo di tecniche analitiche. La conoscenza e l’analisi delle sequenze del genoma umano che presentano differenze interindividuali permette di definire un profilo genetico unico per ogni individuo. Se si escludono infatti i gemelli monovulari, la probabilità di avere due profili genetici identici, con il livello di sensibilità oggi disponibile, è dell’ordine di 1 su
Il 10 settembre 1984 Alec Jeffrey, genetista britannico, fece il primo DNA fingerprinting della storia. Il primo caso giudiziario risolto con il DNA fingerprinting fu l’identificazione dell’assassino di due ragazze adolescenti, entrambe di 15 anni, Lynda Mann e Dawn Ashworth, rapite e uccise a Narborough (Inghilterra) rispettivamente nel 1983 e nel 1986. A seguito di analisi di campioni di sperma prelevati dai corpi delle due ragazze, Colin Pitchfork, vista la corrispondenza tra i profili genetici dei campioni e il suo DNA, fu identificato e condannato per il loro omicidio. Inoltre, l’analisi del DNA permise di scagionare Richard Buckland inizialmente sospettato di essere l’autore dei due assassinii.
Bibliografia
- Vazza Giovanni, Università di Padova, Corso di aggiornamento per docenti “Dal doppio legame al DNA Fingerprinting”, Dispensa e ppt, LS Fermi Padova, 10 marzo 2017;
- Fondazione Golinelli, Un giorno di formazione per insegnanti, Appunti di esperimento “I test genetici”, Liceo Valle Padova, 27 settembre 2016;
- Biorad, Biotechnology Explorer Forensic DNA Fingerprinting Kit, Manuale di istruzione, dal sito www.biorad;
- MUSE di Trento, Laboratorio DNA profiling, Appunti di esperimento , Muse di Trento, 13 febbraio 2015;
- Nelson, Cox, I principi di biochimica di Lehninger, Zanichelli 2014;
- Lewin, Il gene VI, Zanichelli 2002.
Autori
Schmidt Nicoletta
Specifiche esperimentoMateria Biologia Classi a cui è rivolto 5° anno Tipologia di laboratorio Attrezzato Reperibilità del materiale Negozi specializzati, siti web Materiale specifico Camera per elettroforesi orizzontale con alimentatore, piastra riscaldante o forno a microonde, incubatore, minicentrifuga (opzionale), un pennarello indelebile, vetreria da laboratorio, colorante Orange e per DNA Durata esperimento in classe 3 h Capacità di bricolage/assemblaggio No Necessità lavorazioni meccaniche/elettroniche No Necessità PC per acqusizione/analisi dati No Necessità di uno smartphone No Parole chiave Biologia Genetica DNA Marcatori STR |