L’attività permette agli studenti di esplorare le trasformazioni chimiche attraverso esperimenti pratici e modellizzazione molecolare. Dopo un’introduzione con semplici reazioni, come quella tra aceto e bicarbonato di sodio, si analizza la formazione dello slime partendo dalla domanda investigabile: come avviene questa trasformazione?
Gli studenti esaminano i reagenti principali: colla liquida (contenente polivinil-alcol), acqua borica e bicarbonato di sodio. Attraverso la costruzione di modelli molecolari, si prevede che il bicarbonato trasformi l’acido borico in ione borato, il quale si lega ai polimeri della colla tramite legami idrogeno, creando una rete che conferisce allo slime la sua tipica consistenza elastica.
Durante l’esperimento, i ragazzi testano diverse quantità di reagenti per osservare come influenzano la consistenza del materiale. Scoprono così che un eccesso di borato rende lo slime poco elastico e duro, mentre una quantità insufficiente lo rende troppo liquido.
L’attività stimola la sperimentazione, il pensiero critico e il problem solving, rendendo la chimica concreta e coinvolgente attraverso un’esperienza diretta e interattiva.

Scheda esperimento
| Classi | 2° – 3° anno |
| Tipologia | Strumentazione semplice o laboratorio attrezzato |
| Durata | 2h, suddivise tra le due fasi |
 |  |  |  |
Scheda sintetica delle attività
- Gli studenti lavorano in gruppi di tre e realizzano preliminarmente semplici reazioni, ad esempio tra aceto e bicarbonato di sodio, per osservare il verificarsi di una trasformazione di alcune sostanze (i reagenti) in altre (i prodotti) con caratteristiche differenti.
- Costruiscono modelli molecolari dell’acido borico, del bicarbonato di sodio, dello ione borato e dei polimeri della colla liquida.
Con la guida dell’insegnante e con il ricorso all’uso dei modelli:
- osservano lo scorrimento delle catene di polimero una sull’altra così come accade nella colla liquida;
- comprendono che dalla reazione tra acido borico e bicarbonato di sodio si produce lo ione borato che cerca atomi di idrogeno con cui legarsi;
- apprendono come lo ione borato, legandosi con legami idrogeno ai polimeri della colla, blocchi l il loro scorrimento formando una rete elastica;
- mescolano i reagenti per creare lo slime testando diverse quantità di bicarbonato e acqua borica per osservare come varia la consistenza al variare della quantità di ione borato prodotto;
- individuano le dosi corrette per ottenere lo slime con la giusta consistenza e comprendono così quanto in chimica sia importante misurare con precisione tutte le quantità.
Risorse
- Colla liquida (anche se glitterata)
- 300g di bicarbonato di sodio
- Acqua Borica (in alternativa, liquido per le lenti a contatto)
- Bilancia e misurino
- Quaderno e penna per annotare le misure
Prerequisiti
- Conoscere la struttura dell’atomo
- Conoscere la tavola periodica degli elementi
- Conoscere i legami chimici.
Obiettivi di apprendimento
- Modellizzare la struttura delle dei composti molecolari e polimeri utilizzando plastilina o stecchini e cannucce oppure con materiali strutturati se presenti in laboratorio
- Fare ipotesi per spiegare il fenomeno investigato sperimentalmente opportunamente guidato dal docente
- Comprendere consapevolmente cosa è una trasformazione chimica
- Comprendere, esercitando le abilità matematico-scientifiche, che con la chimica, le misure sono importanti
Dotazioni di sicurezza
Nessuna
Svolgimento
La scolaresca conosce la struttura dell’atomo, la tavola periodica degli elementi, e i legami chimici.
Conviene far precedere l’attività con approcci laboratoriali anche semplici come la reazione tra aceto e bicarbonato di sodio, per consentire agli alunni di osservare realmente il verificarsi di una trasformazione tangibile di alcune sostanze (i reagenti) in altre (i prodotti) con caratteristiche differenti rispetto a quelle di partenza.
Sperimentando, comprendono che “è successo qualcosa”. Diverse sostanze sono venute a contatto ed è avvenuta una trasformazione che può essere rivelata dalla produzione di un gas oppure dalla formazione di un cristallo o dalla produzione di calore o ancora dalla formazione di un composto colorato. Si può partire con la domanda investigabile: come fanno colla liquida, liquido per lenti e bicarbonato di sodio a diventare slime?
Tante ricette esistono per crearlo ma come funziona davvero? In questo caso bisognerebbe intervenire con un IBSE guidato dal docente perché possano conoscere in modo semplice e adattato alla loro età le caratteristiche delle molecole coinvolte in questa reazione.
Partiamo quindi dalle sostanze di partenza, i reagenti:
- colla liquida che contiene un polimero chiamato Poli-Vinil-Alcool;
- acqua borica che contiene invece acido borico in soluzione acquosa;
- bicarbonato di sodio.
L’acido borico è contenuto anche nel liquido per le lenti a contatto o usato in oftalmologia perché è un disinfettante. Si mostra l’immagine di un modello della molecola di acido borico, che è possibile far costruire con plastilina e stecchini o bastoncini (figura 1).
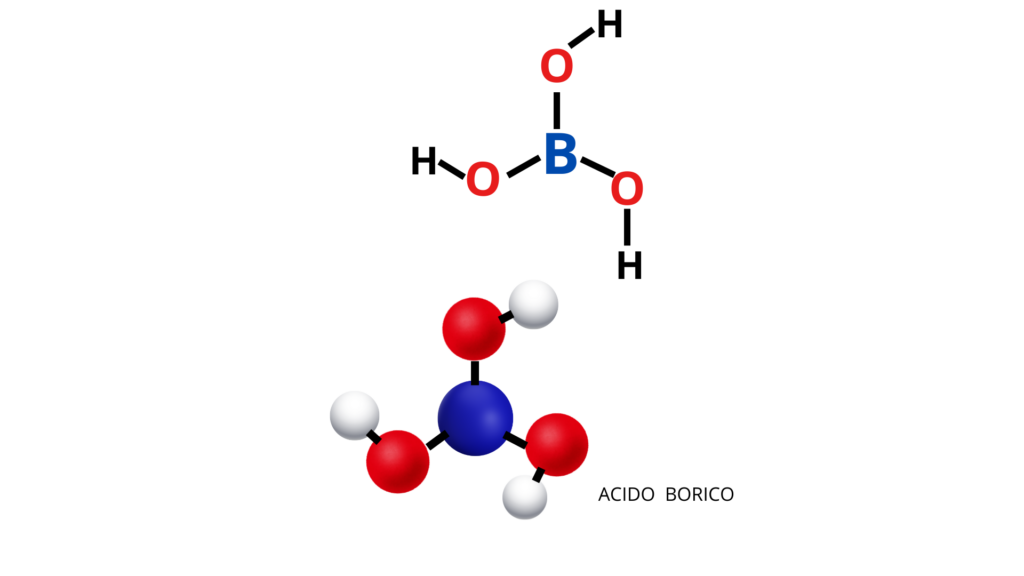
Nello stesso modo si procede per modellizzare il bicarbonato di sodio (figura 2).
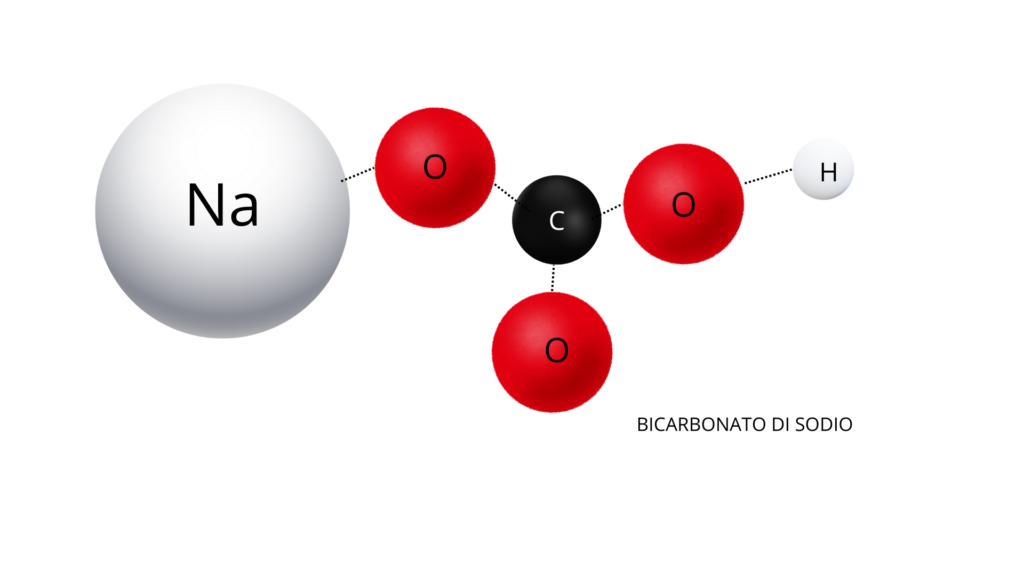
Una volta modellizzate le molecole si può mostrare ai ragazzi che, quando è presente del bicarbonato, questo composto fa staccare gli idrogeni dall’acido borico e si forma lo ione borato.
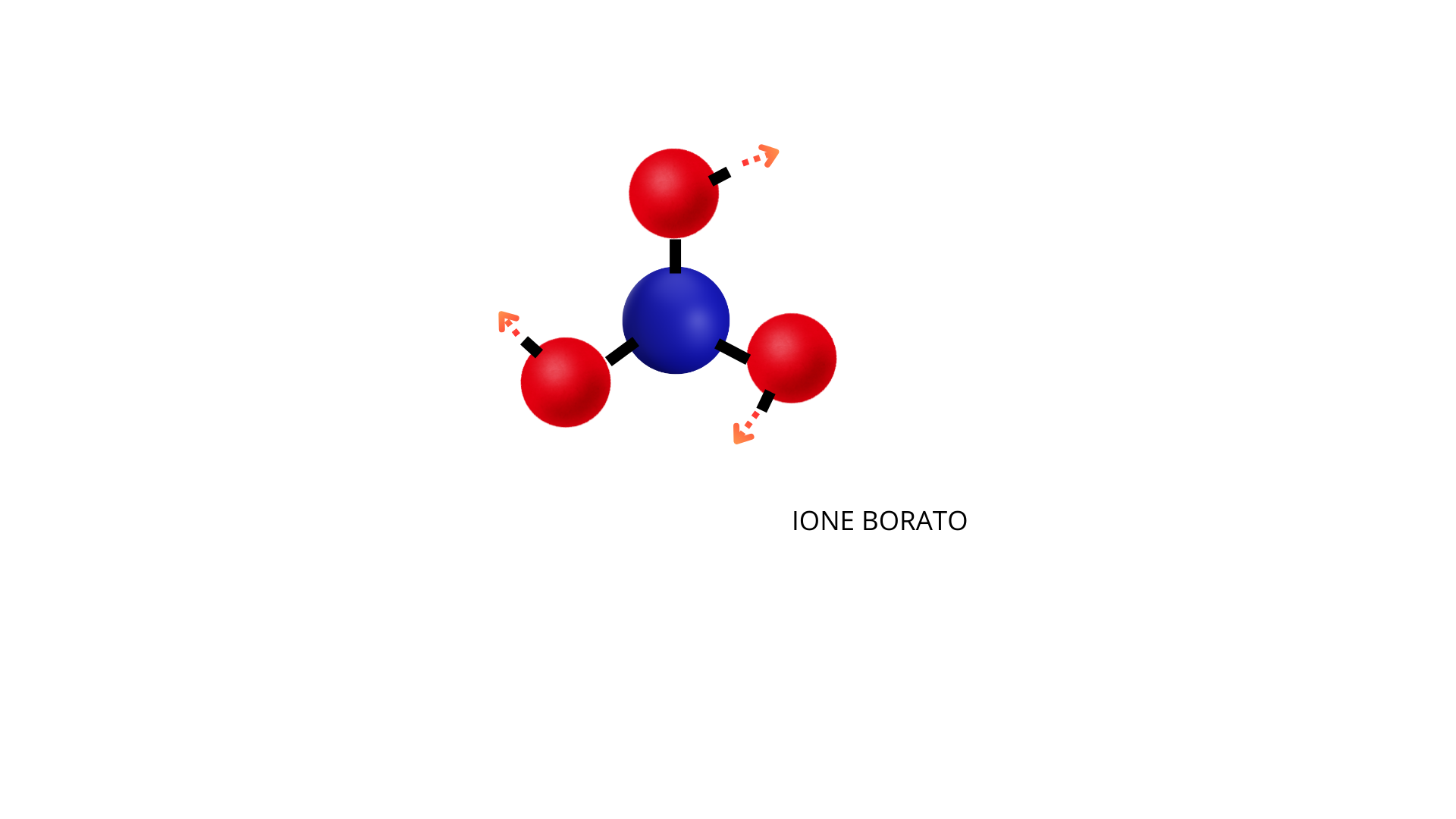
Lo ione borato, quindi, è il modello privo degli atomi di idrogeno perché si sono staccati grazie al bicarbonato di sodio: l’acido borico è diventato ione grazie al bicarbonato.
La colla invece è un polimero, cioè, una lunga catena di molecole tutte uguali (figura 4).
È importante far comprendere ai ragazzi che il polimero è costituito da tante molecole tutte uguali, i monomeri, incatenate l’una all’altra. Anche in questo caso occorre far modellizzare il polimero, costruendo almeno due catene del polimero. In alcuni laboratori ci sono i modelli strutturati con atomi e legami per costruire le molecole ma anche l’utilizzo di plastilina, stecchini di legno, cannucce o altro materiale povero può consentire la modellizzazione.
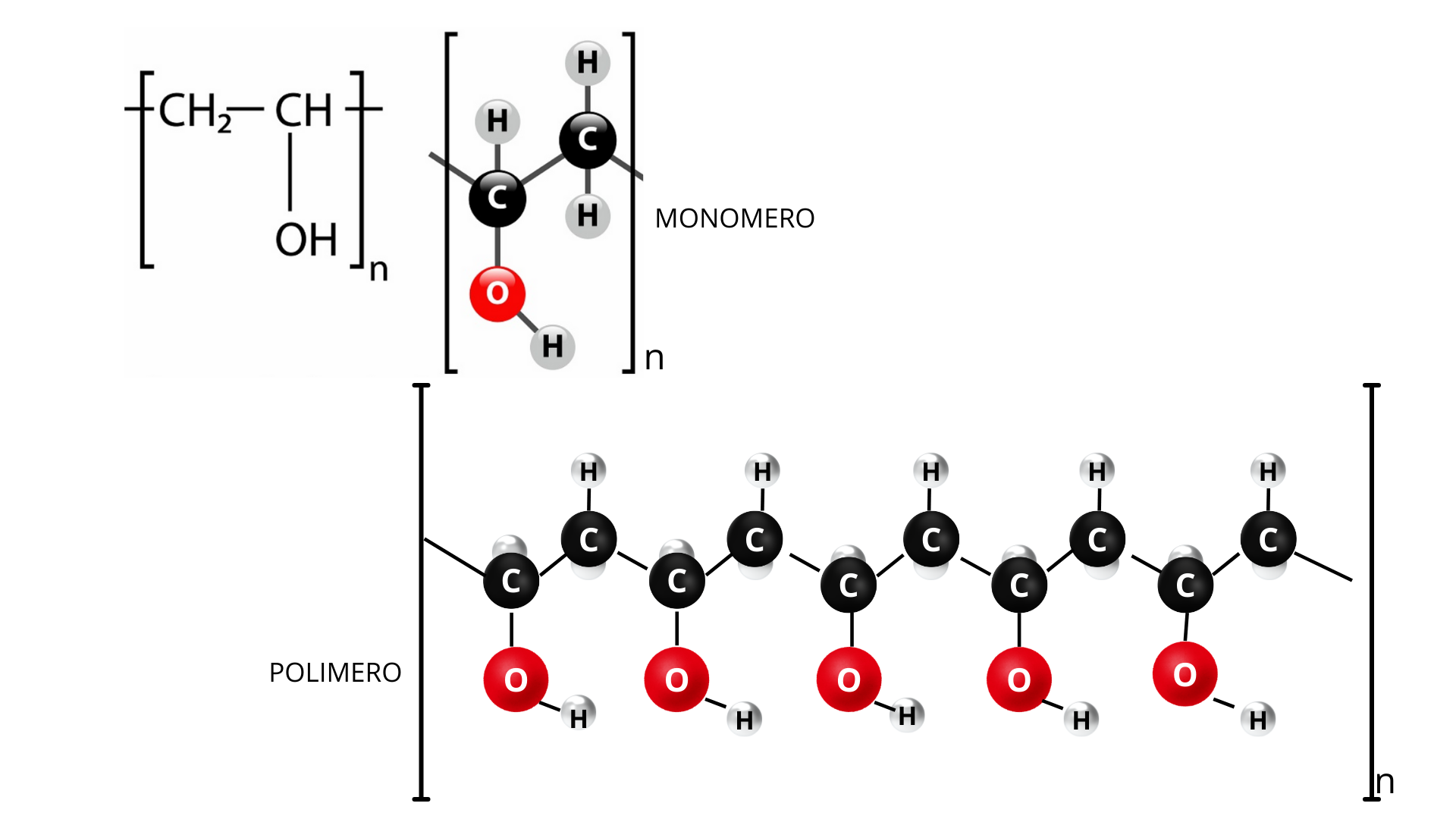
Le molecole di polimero sono presenti nella colla e normalmente, nella colla liquida, queste catene di polimeri non interagiscono fra loro, scivolano l’uno sull’altra, scorrendo senza ostacolarsi nel movimento, come le porte a scomparsa: le catene di polimero non interagiscono tra loro. I ragazzi possono con i modelli simulare lo scorrimento dei polimeri.
La seconda domanda investigabile che guida alla scoperta è: cosa accade se, nella colla liquida, è presente lo ione borato?
Lo ione borato è una molecola molto reattiva perché ha perso i suoi 3 atomi di idrogeni; esso interagisce con i polimeri della colla perché tende a cercare altri atomi di idrogeno. Cercherà e si legherà agli idrogeni dei polimeri, formando dei legami chiamati legami idrogeno.
Si può simulare il legame dello ione borato con due modelli di polimero legandoli attraverso gli idrogeni.
Lo ione borato si lega a più catene, che ora non sono più libere di scorrere una sull’altra come accadeva prima. Questa osservazione si può mostrare concretamente anche con i modelli; si forma una rete di polimeri difficile da staccare uno dall’altro, perché le molecole non scivolano più una sull’altra e così non riescono più a scivolare anche i polimeri dei modelli.
Questo è quello che accade quando il borato reagisce con i polimeri della colla, formando lo slime.
Quando allunghiamo lo slime forniamo energia che rompe i legami idrogeno temporaneamente, che poi si riformano. Il rompersi e riformarsi dei legami idrogeno è la causa della particolare struttura elastica dello slime.
A questo punto i ragazzi, organizzati in gruppi, disponendo dei materiali creano lo slime e si cimentano con le dosi necessarie di ogni reagente:
- se è troppo duro e poco elastico c’è troppo borato;
- se è troppo molle e non è elastico c’è poco borato.
Riescono così ad individuare le dosi giuste.
Si procede poi con il calcolo delle quantità necessarie e la pesa degli ingredienti.
Quando si tratta di chimica, le misure sono importanti, occorre usare una bilancia per pesare gli ingredienti con precisione.
E…Eureka!
Divertirsi mentre si impara è garantito!
Note e storia
L’attività coinvolge molto i ragazzi che riescono con vari tentativi ad individuare le giuste dosi per uno slime perfetto. Le misure non sono standard perché dipendono dalla colla liquida di cui si dispone. Se si pensa di utilizzare sempre lo stesso tipo di colla l’insegnante può disporre della misura precisa dei vari reagenti e supportare con suggerimenti i gruppi di lavoro perché raggiungano prima l’obiettivo. L’aggiunta di colorante alimentare rende l’attività più divertente.
Durante la sperimentazione i discenti hanno acquisito il concetto di “legame idrogeno” e hanno compreso che può rompersi e riformarsi continuamente proprio giocando con lo slime che hanno prodotto. Hanno compreso che non è un legame rigido. Quanto appreso ha avuto una ricaduta a distanza di tempo in quanto gli stessi alunni hanno compreso senza alcuna difficoltà come avviene la separazione dei due filamenti di DNA per la duplicazione perché questi sono tenuti insieme da ponti idrogeno.
Bibliografia
Autori
Margherita Sivo, I.C. “Papa Giovanni XXIII – Capozzi – Galilei”, Valenzano (BA)
Ha contribuito a ottimizzare l’esperimento:
Salvatore F. Altavilla, I.C. 1 di Modena, Modena