L’esperimento consente di determinare in modo semplice il coefficiente di dilatazione dei gas e di verificare l’esistenza dello zero assoluto.

Scheda esperimento
| Classi | 1° e 2° biennio |
| Tipologia | Strumentazione semplice |
| Durata | 1 h |
 |  |  |  |
Scheda sintetica delle attività
Si propone una versione semplificata dell’esperimento che verifica la prima legge di Gay Lussac, così articolata:
- si determina il volume dell’aria racchiusa in una beuta alle temperature di 100 °C e di 0 °C;
- si calcola il valore della costante dei gas;
- si verifica graficamente l’esistenza dello zero assoluto.
Risorse necessarie
- Una beuta resistente al calore;
- un bicchiere pirex piuttosto grande (che contenga la beuta);
- un basamento con asta e morsetti per sostenere la beuta;
- un bunsen con treppiede e reticella, oppure una piastra elettrica scaldante;
- un tappo forato;
- un tubicino di vetro;
- una bacinella con acqua e ghiaccio in equilibrio termico;
- un termometro;
- un cilindro graduato da
\(500\ cm^3\) e risoluzione \(5\ cm^3\); - un cilindro graduato da \(100\ cm^3\) e risoluzione \(1\ cm^3\).

Prerequisiti necessari
- Leggi di propagazione degli errori nelle misure indirette;
- costruzione di grafici (eventualmente utilizzo del foglio elettronico);
- dilatazione termica dei materiali.
Obiettivi di apprendimento
- Valutare gli errori nelle misure dirette e indirette;
- confrontare valori misurati con valori accettati;
- usare un foglio elettronico per costruire un grafico.
Dotazioni di sicurezza
Per ragioni di sicurezza, l’esperimento deve essere condotto dall’insegnante in presenza di un tecnico di laboratorio.
Svolgimento
Realizzazione dell’esperimento
- Determinare preventivamente il volume dell’aria, riempiendo la beuta di acqua, con il tappo e tubicino inseriti, travasandola poi nel cilindro graduato da \(500 cm^3\). Asciugare perfettamente l’interno della beuta (l’aria contenuta al suo interno sostituisce il gas ideale).
- La bacinella contenente acqua e ghiaccio in equilibrio termico deve essere abbastanza profonda per immergere completamente la beuta.
- Dopo aver inserito l’acqua nel bicchiere di pirex s’immerge quasi completamente la beuta sostenuta dai morsetti, perché non appoggi sul fondo del recipiente e si porta l’acqua ad ebollizione.
- Facendo molta attenzione, si chiude il tubicino e, utilizzando il morsetto, si estrae la beuta dall’acqua bollente e la si inserisce capovolta nella bacinella contenente il miscuglio di acqua e ghiaccio (figura 2).

- Aprendo il tubicino, una certa quantità di acqua entra allora nella beuta, in quanto l’aria in essa contenuta si è raffreddata. L’apertura del tubicino può essere effettuata non appena l’estremità è in acqua e quindi non è necessario immergere anche l’avambraccio nel recipiente. In questo modo è possibile usare un recipiente abbastanza piccolo (20 – 25cm di diametro e profondo tanto da immergere completamente la beuta in verticale) e diventa facile lasciare immersa la beuta per un tempo sufficiente a raggiungere l’equilibrio termico, ovvero fino a quando non si osservano variazioni apprezzabili del livello dell’acqua risucchiata. Il termometro garantisce la temperatura di 0 °C tuttavia, considerando che la densità dell’acqua è massima a 4 °C, è possibile ci sia un gradiente termico tra fondo e superficie, se il ghiaccio è poco e mal macinato; sarebbe quindi utile mescolare dolcemente l’acqua durante il processo di raffreddamento.
- Richiudendo il tubicino, si estrae la beuta.
Durante questa operazione è necessario considerare l’effetto della pressione idrostatica (e, eventualmente stimolare la discussione con gli studenti): quando l’estremità del tubicino si trova ad esempio ad una profondità di circa 20 cm, parte dell’aria rientra per effetto della pressione idrostatica che a questa profondità è circa 0.02 atmosfere maggiore rispetto alla superficie libera (con un errore di circa il 2%), in questo caso si sovrastima l’acqua risucchiata e quindi si sottostima la variazione di volume. L’effetto si potrebbe valutare preventivamente inserendo in acqua la beuta a temperatura ambiente e verificando la quantità di acqua risucchiata quando questa è immersa completamente. Per ovviare a questo effetto sistematico sarebbe meglio che, estraendo la beuta, si tappi il tubicino quando questa si trova in prossimità della superficie dell’acqua.
- Si versa, infine, l’acqua raccolta nel cilindro graduato piccolo.
Dati e valutazione degli errori sperimentali
I valori ottenuti sono i seguenti:
- Volume aria a 100 °C : \(V_{100} = \left( 288 \pm 2 \right)\ cm^3\)
Le incisioni sul cilindro graduato da \(500\ cm^3\) sono sufficientemente spaziate e un po’ di pratica consente, mediante interpolazione, una risoluzione di \(1\ cm^3\). Considerando tuttavia la difficoltà nel travasare completamente l’acqua contenuta nella beuta, sembra ragionevole una stima di \(2\ cm^3\) sull’incertezza del volume dell’aria.
- Il volume dell’acqua entrata nella beuta è: \(V_{H_2O} = \left(76 \pm 1 \right)\ cm^3\)
- Il volume dell’aria a 0 °C è \(V_0 = V_{100} – V_{H_2O}\ =\ 288\ cm^3 – 76\ cm^3\ =\ 212\ cm^3\)
Utilizzando la somma in quadratura, l’errore su \(V_0\) è:
\[\Delta V_0 = \sqrt{\Delta V_{100}^2 + \Delta V_{H_2O}^2} = 2\ cm^2\]
Dalla legge di Volta e Gay-Lussac: \(V = V_0\left(1 + \alpha t\right)\) si ricava il coefficiente di dilatazione \(\alpha\):
\[\alpha = \frac{V_{100} – V_0}{V_0 \cdot t} = \frac{\left(288 – 212\right)\ cm^3}{\left(212 \ cm^3 \right) \cdot 100\ ^0C}= 0,0036\ ^0C^{-1}\]
L’errore relativo su \(\alpha\) così calcolato, supponendo che le misure siano indipendenti, è:
\[\frac{\Delta \alpha}{\alpha} = \sqrt{\left( \frac{\Delta \left( V_{100}- V_0 \right)}{V_{100}-V_0} \right)^2 + \left(\frac{\Delta V_0}{V_0} \right)^2 + \left( \frac{\Delta t}{t} \right)^2} = \sqrt{ 1,7 \cdot 10^{-4} + 1,1 \cdot 10^{-4} + 4,0 \cdot 10^{-4}} = 2,6 \cdot 10^{-2}\]
L’errore su \(\alpha\) risulta così: \(\Delta \alpha = \left(2,6 \cdot 10^{-2} \right) \cdot \left(0,0036\ ^0C^{-1} \right)= 1 \cdot 10^{-4}\ ^0C^{-1}\)
Riassumendo abbiamo:
\[\alpha = \left( 3,6 \pm 0,1\right) \cdot 10^{-3}\ ^0C^{-1}\]
La valutazione degli errori nelle misure della temperatura si presenta complessa per diverse ragioni. Quando la beuta viene tenuta nella miscela di acqua e ghiaccio, non siamo certi che la temperatura finale dell’aria dentro la beuta sia scesa esattamente a 0 °C; inoltre, la temperatura di tutta la miscela di ghiaccio e acqua dovrebbe essere esattamente alla temperatura di fusione del ghiaccio, affinché immergendovi la beuta di vetro a circa 100 °C, la temperatura della miscela non cambi (ma venga solo fuso altro ghiaccio). Ritengo che l’incertezza nella misura di t a 0 °C porti probabilmente ad un Δt dell’ordine di 2 °C.
L’esperienza può essere utilizzata per una verifica dell’esistenza dello zero assoluto e per dare una giustificazione della definizione della scala Kelvin.
È sufficiente costruire un grafico che rappresenta il volume V in funzione della temperatura t ed estrapolare la retta fino alla sua intersezione con l’asse t (figura 3)
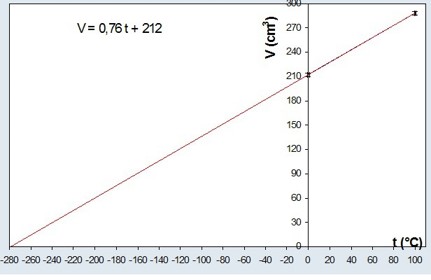
Osservazioni finali
- L ’esperienza presenta due “punti critici”. Nella fase sperimentale, la variabile che influenza maggiormente il valore di α calcolato è il volume di acqua che entra nella beuta durante l’immersione nell’acqua fredda. Una manovra errata può condurre a valori di α incompatibili con quello accettato. Inoltre, nella fase di elaborazione, il grafico è costruito con due soli dati sperimentali e l’estrapolazione eseguita a grande distanza. Ogni incertezza nei dati risulta così molto amplificata.
- L’inserimento di un terzo punto nel grafico, corrispondente ad esempio, al volume dell’aria a temperatura ambiente, porterebbe qualche miglioramento nell’estrapolazione, ma introdurrebbe complicazioni operative, allungando i tempi di esecuzione della prova.
- Per semplificare ulteriormente l’esperimento, eliminando eventuali problemi di reperibilità del ghiaccio, avendo sempre a disposizione un termometro, si potrebbe sostituire la misura a 0 °C con una misura a temperatura ambiente.
- È noto che il punto di ebollizione dei liquidi varia con la pressione esterna. L’esperimento è stato eseguito nella città di Pesaro, che si trova a livello del mare. Esperimenti condotti in località più elevate dovrebbero tenere in considerazione la riduzione della pressione atmosferica e di conseguenza l’abbassamento del punto di ebollizione dell’acqua.
Approfondimenti
È interessante confrontare i dati ottenuti con la curva nota della dilatazione termica dell’aria secca, facilmente reperibile sul Web.
Si nota che il coefficiente di dilatazione termica dell’aria secca è tutt’altro che costante: varia infatti del 30% passando da \(0,00367 K^{-1}\) per t=0 °C a \(0,00268 K^{-1}\) per t=100 °C.
La curva che si ottiene integrando numericamente i dati (usando ad esempio un valore medio per il coefficiente di espansione tra due temperature partendo dal volume a 0 °C ) è molto vicina ai valori trovati (\(212 cm^3\) per t=0 °C e \(288 cm^3\) per t=100 °C).
I dati ottenuti integrando numericamente la curva teorica di espansione dell’aria secca sono mostrati in tabella 1:
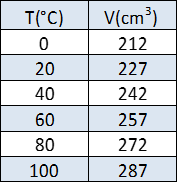
Utilizzando i dati della teoria, il coefficiente di espansione che si ottiene è: \(0,00354 K^{-1}\), con una differenza rispetto al valore ottenuto inferiore al 2%. Anche il coefficiente angolare della retta di regressione ottenuto sperimentalmente (\(0,76 cm^3/K\)) è molto vicino al valore teorico che si ottiene utilizzando una retta di regressione sulla curva teorica (\(0,751 cm^3/K\)).
A questo punto è lecito chiederci perché il risultato sperimentale non fornisca il valore atteso (-273.15 C). Estrapolando la retta dei dati sperimentali a Y = 0 si ottiene \(T_0= -279°C\). Questo valore andrebbe confrontato con il valore atteso nel caso dell’aria, che possiamo ottenere usando i dati tabulati e applicando una retta di regressione ai valori teorici a 0 °C e 100 °C, ottenendo \(T_0 = -283 °C\).
E’ sicuramente interessante vedere come un effetto anche grande sulla variazione del coefficiente di espansione dell’aria (30% !!) non dia poi un effetto cosi grande sul comportamento del gas e sulla stima dello zero assoluto (3% di differenza rispetto ad un gas perfetto). Tuttavia il confronto con i dati indica che la discrepanza tra valore atteso e valore misurato non può essere solo ascritto ad “errori di misura” o meglio, negli errori di misura bisogna considerare il sistema che si sta studiando e che non è un gas perfetto.
A conclusione di ogni attività di laboratorio è sempre utile una discussione che spinga gli studenti a capire il risultato di una misura, il perché di una differenza e le possibili sorgenti di errore. L’obiettivo di un esperimento non è quello di confermare per forza una legge stabilita. Anzi, tale discussione è sicuramente più stimolante nel caso in cui l’esperimento non si è concluso come previsto.
Autori
Della Michelina Loris
Schede / Allegati